Forskjell mellom normal hemoglobin og sylcellehemoglobin | Normal Hemoglobin vs Sickle Cell Hemoglobin
Nøkkelforskjell - Normal Hemoglobin vs Sickle Cell Hemoglobin
Hemoglobin (Hgb) er hovedproteinmolekylet som gir Den typiske formen på den røde blodlegemet - rund form med et smalt senter. Hemoglobinmolekylet består av fire subproteinmolekyler der to kjeder er alfa-globulinkjeder, og de andre to er beta-globulinkjeder. Jernatomer i hemoglobin og formen på de røde blodcellene er viktige for oksygentransport gjennom blod. Hvis formen på hemoglobin blir ødelagt, klarte det ikke å transportere oksygen gjennom blodet. Sykelcellehemoglobin er en type av et unormalt hemoglobinmolekyl som forårsaker en anemi-tilstand som kalles seglcelleanemi. Hovedforskjellen mellom normal hemoglobin og seglcellehemoglobin er at normalt hemoglobin har glutaminsyre i posisjonen 6 th av aminosyresekvensen av beta-globulinkjeden mens seglcelle hemoglobin har Valine i 6 th -posisjonen av beta-globulinkjeden. Normal hemoglobin og seglcellehemoglobin er bare forskjellig med en enkelt aminosyre i beta-kjeder.
INNHOLD
en. Oversikt og nøkkelforskjell
2. Hva er normalt hemoglobin
3. Hva er Sickle Cell Hemoglobin
4. Side ved side sammenligning - Normal Hemoglobin vs Sickle Cell Hemoglobin
5. Sammendrag
Hva er normalt hemoglobin?
Hemoglobin er et jernholdig metalloprotein som finnes i røde blodlegemer. Det er ansvarlig for transport av oksygen fra lungen til kroppens vev og organer, og transport av karbondioksid fra kroppsvev til lungen. Det er også kjent som oksygenbærende protein i blodet. Det er et komplekst protein, som består av fire små proteinunderenheter og fire hemgrupper som bærer jernatomer som vist i figur 01. Hemoglobin har en høy affinitet for oksygen. Det er fire oksygenbindingssteder plassert i et hemoglobinmolekyl. Når hemoglobin er mettet med oksygen, blir blodet rødt rødt og er kjent som oksygenert blod. Den andre tilstanden til hemoglobin, som mangler oksygen, er kjent som deoksyhemoglobin. I denne tilstanden bærer blod den mørkrøde fargen.
Jernatomer innebygd i hemforbindelsen av hemoglobin letter hovedsakelig oksygen- og karbondioksidtransport.Binding av oksygenmolekyler til Fe +2 ioner endrer konformasjonen av hemoglobinmolekylet. Jernatomer i hemoglobin bidrar også til å opprettholde den typiske form av den røde blodcellen. Derfor er jern et viktig element som finnes i de røde blodcellene.
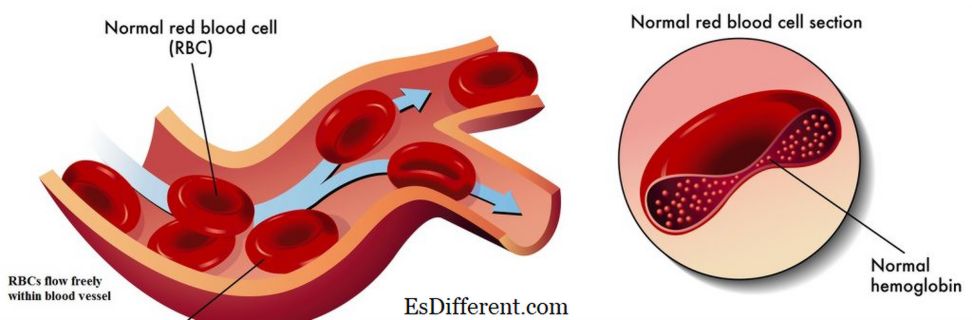
Figur 01: Normal Hemoglobin
Hva er Sickle Cell Hemoglobin?
Syklecelleanemi er en blodtilstand forårsaket på grunn av unormale hemoglobinproteiner som finnes i de røde blodcellene. Sykelcellehemoglobin er en type unormal hemoglobin funnet i røde blodceller. De er også kjent som hemoglobin S. De har segl eller halvmåneformer. De er produsert som følge av seglcellegenmutasjon. Denne mutasjonen endrer en enkelt aminosyre i aminosyresekvensen av normalt hemoglobin beta-kjedepeptid. Sikkelcellehemoglobin består også av to alfa og to beta-underenheter, akkurat som normalt hemoglobin. Imidlertid er det en enkelt aminosyreforskjell i beta-underenheter på grunn av mutasjonen. I normal hemoglobin er 6 th posisjonen til aminosyrekjeden i beta-kjeder sammensatt av glutaminsyre. Men i seglcellehemoglobin plasseres 6 th posisjonen av en annen aminosyre som kalles valin. Selv om det er en enkelt aminosyre forskjell, er det årsaken til livstruende anemi sykdom kalt seglcelle sykdom.
Når valin er plassert på 6 th , forårsaker betakjeden å danne et fremspring som passer med betakjeder av andre hemoglobinmolekyler. Disse forbindelsene gjør seglcellehemoglobin til å aggregere hverandre uten å forbli i løsningen og transportere oksygen. Det tar en stiv struktur, og til slutt bryter røde blodlegemer ned tidlig, noe som fører til anemi.

Figur 02: Syklecellehemoglobin
Hva er forskjellen mellom normal hemoglobin og sylcellehemoglobin?
- diff Artikkel Mellom før Tabell ->
Normalt Hemoglobin vs Sickle Cell Hemoglobin |
|
| Normalt hemoglobin er et jernholdig protein i de røde blodcellene, som transporterer oksygen og karbondioksid gjennom blodet. | Sykelcellehemoglobin er en type unormal hemoglobin som forårsaker agglutinering av seglformet røde blodlegemer i blodet. |
| Forkortelse | |
| Forkortelse av det normale hemoglobin er HbA . | Forkortelse av seglcellehemoglobin er HbS . |
| Struktur | |
| Strukturen av normalt hemoglobin består av to alfa kjeder og to betakjeder. | Struktur av seglcellehemoglobin består av to alfa kjeder og to S-kjeder. |
| Form | |
| Normal hemoglobin er rund med et smalt senter. | Formen på den røde blodcellen inneholder seglcellehemoglobin er halvmåne eller seglform. |
| 6. Aminosyreposisjon | |
| Den sjette posisjonen i aminosyrekjeden av beta-globulinkjeden er glutaminsyre. | Den sjette posisjonen er okkupert av valin i seglcellehemoglobiner. |
| Resultat | |
| Normal hemoglobin fører til at røde blodceller strømmer fritt i blodkarene. | Sykelcellehemoglobin forårsaker blokkering av røde blodceller i karene. |
Sammendrag - Normal Hemoglobin vs Sickle Cell Hemoglobin
Hemoglobin er det oksygentransporterende proteinet i røde blodlegemer. Den består av fire underenheter av proteiner kalt alfa- og betakjeder. Det er et jernholdig molekyl som forårsaker fargene og den runde formen av de røde blodcellene. På grunn av mutasjoner kan formen på de røde blodcellene variere. Det skjer på grunn av unormale hemoglobinmolekyler i de røde blodcellene. Sikkelcellehemoglobin er en slik mutasjon. De forandrer formen på de røde blodcellene fra runde til seglform, noe som til slutt fører til for tidlig ødeleggelse av røde blodlegemer. Denne tilstanden er kjent som seglcelleanemi. Imidlertid er forskjellen mellom normal hemoglobin og seglcellehemoglobin en enkelt aminosyreforskjell i beta-kjeden av hemoglobin.
Referanse:
1. Den molekylære biologi av sykelcelleanemi. N. p., n. d. Web. 28. mai 2017..
2. "Syklecelle sykdom - Genetikk hjemme referanse. "U. S. National Library of Medicine. National Institutes of Health, n. d. Web. 28. mai 2017.
Image Courtesy:
1. "Risk-Factors-for-Sickle-Cell-Anemia (1) 2" Av Diana Grib - Eget arbeid (CC BY-SA 4. 0) via Commons Wikimedia [Beskåret]


