Forskjell mellom monatomisk og diatomisk | Monatomisk vs Diatomisk
Forskjellen mellom monatomisk og diatomisk er primært med hensyn til atomene tilstede i arten. Som navnene antyder, står begge disse betingelsene for forskjellige tilstander av atomforeninger hvor "mono" betyr "en" og "di" betyr "to". 'Derfor betyr bare monatomisk ett'
ett atom 'og diatomisk betyr' to atomer. ' Det kan imidlertid være så mange forskjellige variasjoner i denne grunnleggende definisjonen.
Hva er monatomisk?Når
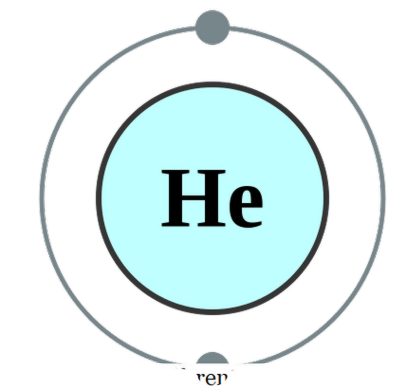
eksisterer et eget atom på egen hånd (som sjelden er tilfelle), kaller vi det monatomisk. Dette betyr at elementene er i deres rene singular form. Det eneste praktiske eksemplet som kan komme under denne kategorien, ville være de edle gasser som eksisterer som atomer alene fordi de har sitt ytre skall ferdiggjort med en oktett av elektroner. Derfor ser de ikke ut til å akseptere eller donere flere elektroner for å være mer stabil. Derfor er edle gasser stabile i monatomisk form. Noen eksempler er; Han - Helium, Ne - Neon, Ar - Argon, Xe - Xenon, Kr - Krypton, Rn - Radon.
Hva er diatomisk?
Når
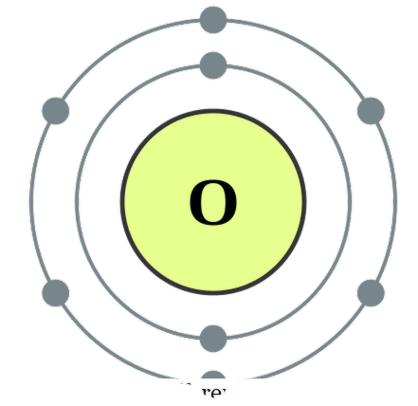
to atomer er i forbindelse med hverandre , kaller vi det diatomiske. Disse atomene kan være av samme type eller forskjellige. Når de er to lignende atomer i forening, kaller vi det ' homonukleære diatomer ' og hvis de er laget av forskjellige typer, kaller vi det heteronukleære diatomer '. Eksempler på noen homonukleære diatomer ville være O2, N2, H2, etc. mens CO, NO, HCI, etc. kan gis som eksempler på heteronukleære diatomer. Syrer
Diatomer kan betraktes som forbindelser som de danner disse foreningene for å oppnå mer stabilitet ved å dele elektroner med hverandre, slik at begge atomer oppnår edelgass elektronisk konfigurasjon. De kan binde gjennom kovalente bindinger ved overlapping av atomorbitaler, ellers kan de danne ioniske bindinger blant dem som er en tiltrekningskraft mellom en positivt ladet art og en negativt ladet art. Eksempler på kovalente bindinger blant diatomer inkluderer CO, NO, etc., og HCI kan betraktes som en art med ionisk tiltrekningskarakter. Men som tiltrekningskraften mellom H + og Cl- er ikke veldig sterk, er det ikke et veldig godt eksempel på ioniske bindinger som er et annet definert emne.
Hva er forskjellen mellom monatomisk og diatomisk?
• Monatomiske arter har et atom mens diatomiske arter har to atomer.
• Monatomiske arter er generelt ikke stabile, men diatomiske arter er generelt stabile.
• Noble gasser er bare monatomiske og finnes ikke i diatomisk form.
• Kjemiske bindinger eksisterer mellom diatomiske arter mens det ikke er noen bindinger i monatomiske arter.
Bilder Courtesy:
Helium elektronkonfigurasjon av Pumbaa (CC BY-SA 2. 0 uk)
- Oxygen elektronkonfigurasjon av DePiep (CC BY-SA 3. 0)


