Forskjell mellom isotonisk og hypertonisk | Isotonisk vs Hypertonisk
Hovedforskjell - Isotonisk vs Hypertonisk
Det er viktig å forstå konseptet Tonicity før man analyserer forskjellen mellom isotonisk og hypertonisk. Derfor, la oss først beskrive konseptet tonicity og dets betydning kort. Tonicitet er variansen i vannkonsentrasjon av to løsninger delt med en semipermeabel membran. Det kan også forklares som den relative vannkonsentrasjonen av løsninger som bestemmer retningen og mengden av diffusjon av vann til den oppnår like konsentrasjoner på begge sider av membranen. Ved å identifisere tonicitet av løsninger, kan vi bestemme i hvilken retning vann vil diffundere. Dette fenomenet blir ofte brukt når man illustrerer responsen til celler nedsenket i en ekstern løsning. Det er tre klassifiseringer av tonicitet som en løsning kan ha forhold til en annen. De er hypertoniske, hypotoniske og isotoniske. nøkkelforskjellen mellom isotonisk og hypertonisk er at den hypertoniske løsningen inneholder mer løsningsmiddel enn løsemiddel mens løsningsmidlet og løsningsmidlet er like fordelt i den isotoniske løsningen. Imidlertid er det ikke viktig å huske definisjonen av hypertoniske og isotoniske løsninger hvis vi kan forstå forskjellen mellom isotoniske og hypertoniske løsninger.
Hva er Hypertonic?
Hyper er et annet ord for over eller overdreven. Hypertoniske løsninger vil ha høyere konsentrasjon av løsemiddel (glukose eller salt) enn cellen. Løsemidler er elementene som oppløses i et løsningsmiddel, og danner derved en løsning. I en hypertonisk løsning er konsentrasjonen av oppløsninger større utenfor cellen enn i den. Når en celle er nedsenket i en hypertonisk løsning, vil det bli et osmotisk skift og vannmolekyler vil strømme ut av cellen for å balansere konsentrasjonen av løsningsmidlene og det vil bli krymping i cellens størrelse.
Hva er isotonisk?
Iso er et annet ord for lik og tonisk er for tonicity av løsningen. Isotoniske løsninger vil ha en lignende konsentrasjon av løsemiddel enn løsningen den blir sammenlignet med. I en isotonisk løsning er konsentrasjonen av oppløsninger det samme både innenfor og utenfor cellen som skaper en likevekt i omgivelsene i den cellulære organisasjonen. Når en celle er nedsenket i en isotonisk oppløsning, vil det ikke være et osmotisk skift og vannmolekyler diffunderer gjennom cellemembranen i begge retninger for å balansere konsentrasjonen av oppløsningsmidlene.Denne prosessen vil ikke skape hevelse eller krymping av cellen.

Hva er forskjellen mellom isotonisk og hypertonisk?
Forskjellene mellom hypertonisk og isotonisk kan klassifiseres i følgende kategorier.
Definisjon av Isotonisk og Hypertonisk
Hypertonisk: "hyper" er kjent som ovenfor eller overdreven + "tonic" er kjent som noe i tråd med en løsning. Således tyder hypertonisk økt tonicitet av løsningen.
Isotonisk: "iso" er kjent som samme + "tonic" er kjent som noe i tråd med en løsning. Således foreslår isotonisk lignende tonicitet av løsningen.
Egenskaper for Isotonisk og hypertonisk
Konsentrasjon av løsemiddel og løsning
Hypertonisk: Løsningen inneholder mer løsningsmiddel enn løsemiddel.
Isotonisk: Løst og oppløsningsmiddel i løsningen fordeles på like måte.
Eksempler
Hypertonisk: Renset vann, fordi ingen / mindre løsemiddel oppløses i det rensede vann, og konsentrasjonen er svært lav i forhold til det cellulære miljøet.
Isotonisk: Salinøsning er en isotonisk til blodplasma hos mennesker
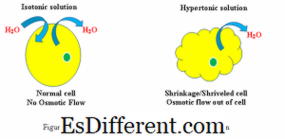
Cellrespons i hypertonisk og isotonisk løsning (se figur 1)
Hypertonisk: Når en biologisk celle er i en hypertonisk miljø, strømmer vann over cellemembranen ut av cellen, for å balansere konsentrasjonen av oppløsninger i begge celler og miljøet rundt cellen. Som et resultat vil cellen krympe som vann forlater cellen for å redusere høyere konsentrasjon av løsemiddel i det ytre miljø.
Isotonisk: Når en celle er i en isotonisk løsning, vil det ikke skape hevelse eller krymping av cellen.
Vannkonsentrasjonsgradient
Hypertonisk: Vannkonsentrasjonsgradient kan observeres fra innsiden av cellen til den hypertoniske løsningen
Isotonisk: Vannkonsentrasjonsgradient eksisterer ikke
Løs konsentrasjonsgradient < Hypertonisk:
Solutt konsentrasjonsgradient er sett fra den hypertoniske løsningen til innsiden av cellen Isotonisk:
Solutt konsentrasjonsgradient eksisterer ikke. Osmotisk skift
Hypertonisk:
osmotisk skift eksisterer. Isotonisk:
Osmotisk skift eksisterer ikke Vannbevegelse
Hypertonisk:
Vannmolekyler beveger seg eller diffuserer raskt fra innsiden av cellen til ytre løsningsretninger, og dermed vil cellen miste vann. Isotonisk:
Vannmolekyler beveger seg eller diffus i begge retninger, og frekvensen av vanndiffusjon er lik i hver retning. Celle vil således enten få eller miste vann. Sportsdrikker
Isotonisk:
En isotonisk drikk består av liknende konsentrasjoner av salt, sukker karbohydrat og elektrolytter som i menneskekroppen. Isotonisk sportsdrikke er ofte foretrukket som en oral rehydrering løsning. Det har vanligvis 4-8g karbohydrat per 100 ml. Hypertonisk:
Hypertonisk drikke inneholder høyere konsentrasjoner av salt, sukker karbohydrat og elektrolytter som i menneskekroppen.Det har vanligvis ca 8g karbohydrat per 100 ml. En hypertonisk løsning brukes også i osmoterapi for å klare cerebral blødning. Hypertonic sportsdrikker er ideelle for de som trenger svært høye nivåer av energi. Til slutt er det tre former for løsninger som er basert på løsemiddelkoncentrasjon og de er isotoniske, hypotoniske og hypertoniske. Konsentrasjonen av oppløsninger er den samme både i og utenfor cellen i en isotonisk løsning. Konsentrasjonen av oppløsninger er større inne i cellen enn det ytre miljøet i en hypotonisk løsning, mens den hypertoniske løsningen er en hvor konsentrasjonen av oppløsninger er større utenfor omgivelsene enn i cellen.
Referanser Mansoor, M. A., Beverly, J., og Sandmann. (2002). Applied Physical Pharmacy. McGraw-Hill Professional. s. 54-57. Voet, D., Judith, G. V. og Charlotte, W. P. (2001). Grunnlag for biokjemi (rev. Ed.). New York: Wiley. s. 30. Image Courtesy: "Osmotisk trykk på blodceller diagram" av LadyofHats - gjorde det selv basert på [1], [2], [3] og [4] … (Public Domain) via Wikimedia Commons.




