Forskjell mellom valency og valence electrons | Valence vs Valence Electrons
Nøkkelforskjeller - Valens vs Valenselektroner
Valenselektroner og valenselektroner er interrelaterte termer, og nøkkelforskjellen mellom valens og valenselektroner er best forklart i sine definisjoner; valenselektroner er elektronene i det ytterste skallet til et element mens valenselektroner er antallet elektroner som bør aksepteres eller fjernes for å oppnå nærmeste edelgasskonfigurasjon. Det er elektronene i det ytre skallet som vanligvis bidrar til å danne kjemiske bindinger. I noen atomer er antall valenselektroner lik antall valenselektroner.
Hva er Valence-elektroner? Antallet elektroner i det ytterste skallet til et atom kalles "valenselektroner". På grunn av denne grunn kalles det ytterste skallet av et atom "valence shell". Mesteparten av tiden er disse elektronene, som deltar i kjemisk binding. Når elementene danner kationer, fjerner de elektroner fra valensskallet. Antall valenselektroner i et element bestemmer gruppen i det periodiske tabellen.

Antallet elektroner som kreves for å få eller miste for å fylle det ytterste skallet til et atom kalles "valenselektroner". For et bestemt atom avhenger antall valenselektroner av antallet valenselektron i atomet. For Natrium er valensen lik 1 fordi den fjerner den siste elektronen i ytterste skall for å oppnå oktetstruktur av nærmeste edelgass.
|
Definisjon av valens og valenselektroner
Valenselektroner:
Elektronene i det ytterste skallet av et atom kalles "valenselektroner". For "s" og "p" gruppeelementer er antall valenselektroner lik deres gruppens nummer. Eksempel
Valenselektroner:
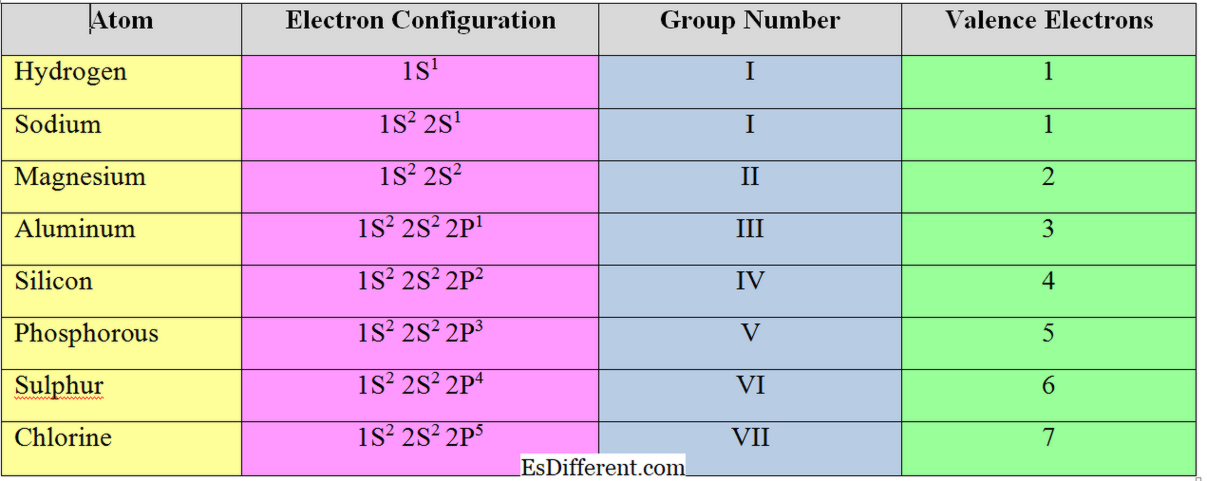
Antallet elektroner som skal aksepteres eller fjernes for å oppnå elektronkonfigurasjonen til nærmeste edelgass kalles "valenselektroner" eller "valens" av et atom. Generelt gjelder for metallelementer (elementer i gruppe I, II og III) antall valenselektroner lik antall valenselektroner; de fjerner elektronene i valensskallet for å oppnå oktetstrukturen.
Men ikke-metallelementer aksepterer elektroner for å oppnå elektronkonfigurasjonen av nærmeste edelgass. Derfor beregnes valensen av ikke-metallelementer ved å subtrahere de totale valenselektronene fra 8.
For klor, Antall valenselektroner = 8-7 = 1
Egenskaper av Valens og Valenselektroner

Valens og Valenselektroner av gruppe VIII-elementer
Valenselektroner:
Gruppe VIII-elementene er de edle gassene, og de er kjemisk stabile. Deres ytre skall er fullstendig, og det inneholder åtte elektroner i det ytre skallet (unntatt Helium -He); slik at gruppe VIII-elektroner har åtte valenselektroner. Valenselektroner:
Valens er et mål på evnen til å danne bindinger med andre elementer eller molekyler. Noble gasser aksepterer eller fjerner ikke elektroner for å oppnå oktetregelen siden de allerede har fullført det siste skallet. Derfor er valensen av gruppe VII-elementene lik null. Image Courtesy:
"Elektronskall 010 Neon - ingen etikett" av commons: Bruker: Pumbaa (original work by commons: Bruker: Greg Robson) - // commons. Wikimedia. org / wiki / Kategori: Electron_shell_diagrams (tilsvarende merket versjon). (CC BY-SA 2. 0 uk) via Commons


