Forskjell mellom S og P blokkelementer | S vs P Block Elements
Nøkkelforskjell - S vs. P blokkelementer
nøkkelforskjellen mellom s og p blokkelementer kan best forklares ved hjelp av deres elektroniske konfigurasjon. I s-blokkelementene fyller den siste elektronen til s-deleskallen og i p-blokkelementer, fyller den siste elektronen til p-deleskalaen. Når de danner ioner s blokkelementer fjerner sine elektroner fra ytre delhull lett, mens p blokkelementer aksepterer elektroner til p-subshell eller fjern elektroner fra p-subshell. Noen elementer i p-gruppen danner positive ioner som fjerner elektroner fra den ytre p-subshell og noen elementer (de mest elektronegative elementene) danner negative ioner som aksepterer et elektron fra andre. Når du vurderer de kjemiske egenskapene, er det en signifikant forskjell mellom s og p blokkelementer; dette skyldes i utgangspunktet elektronkonfigurasjonen.
Hva er S-blokkelementer?
S-blokkelementer er de kjemiske elementene i gruppe I og gruppe II i periodiske tabellen. Siden s subshell kun har plass til to elektroner, har disse elementene vanligvis en (gruppe I) eller to (gruppe II) elektroner i det ytterste skallet. Elementene i gruppe I og II er vist ovenfor i tabellen.
- diff Artikkel Midt før tabell ->| IA | II A | |
| 2 | Li | Be |
| 3 | Na | Mg |
| 4 | K | Ca |
| 5 | Rb | Sr |
| 6 | Cs | Ba |
| 7 | Fr | Ra |
| IA | Alkalimetaller |
| II A | Alkaliske jordmetaller |
Alle elementene i s-blokk danner positive ioner og de er svært reaktive.
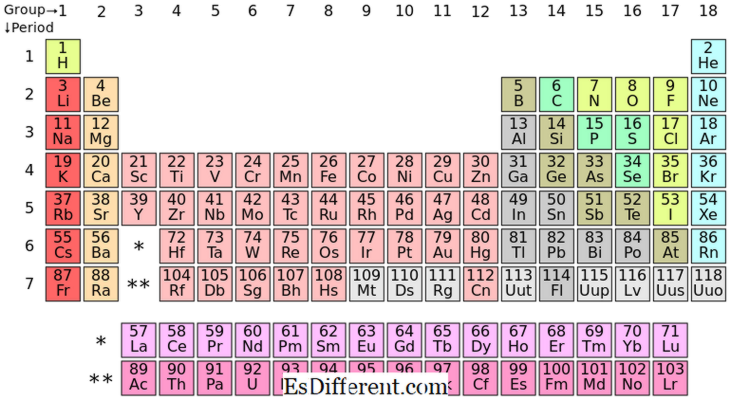
Plasseringen av S-blokkelementene i periodisk tabell
Hva er P-blokkelementer?
P-blokkelementer er elementene hvis siste elektron fylles i p-subshell. Det er tre p-orbitaler; Hver orbitale kan ta imot to elektroner, noe som gjør totalt seks p-elektroner. Derfor har p-blokkelementer en til seks p-elektroner i deres ytterste skall. P-blokk inneholder både metaller og ikke-metaller; i tillegg er det også noen metalloider.
| 13 | 14 | 15 | 16 | 17 | 18 | |
| 2 | B | C | N | O | F ne | 3 |
| Al | Si | P | S | Cl | Ar | 4 |
| Ga | Ge | I | Se | Br | Kr | 5 |
| I | Sn | Sb | Te | I | Xe | 6 |
| Tl | Pb Bi | Po | Ved | Rn | Hva er forskjellen mellom S og P blokkelementer? | Vanlig elektronkonfigurasjon: |
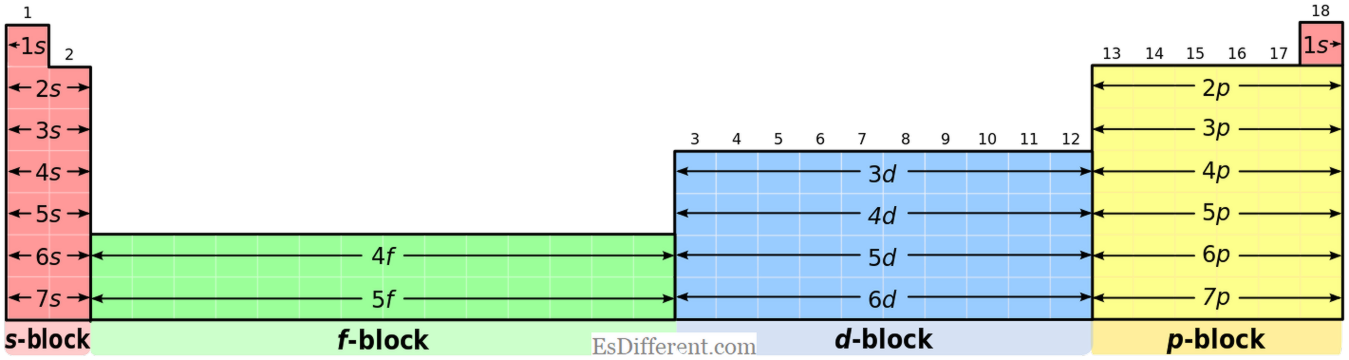
S-blokkelementer:
S-blokkelementer har felles elektronkonfigurasjon av [edelgass] ns
1 (for gruppe I-elementer) og [edelgass] ns 2 (for gruppe II-elementer). P-blokkelementer: P-blokkelementer har felles elektronkonfigurasjon av [edelgass] ns
2 np 1-6 . Men helium har 1s 2 konfigurasjon; det er en spesiell situasjon. Oksidasjonsstater: S-blokkelementer:
S-blokkelementer viser ikke flere oksidasjonstilstander som p-blokkelementer. For eksempel viser gruppe I-elementene +1 oksidasjonstilstand, og gruppe II-elementene viser +2 oksydasjonstilstand.
P-blokkelementer: I motsetning til s-blokkelementene har p-blokkelementer en felles oksidasjonstilstand for deres respektive gruppe i periodisk tabell og noen andre ekstra oksidasjonstilstander avhengig av ionens stabilitet.
Gruppe 13
| 14 | 15 | 16 | 17 | 18 | Generell elektronkonfigurasjon | ns |
| 2 | np 1 ns 2 | np 2 ns 2 | np 3 ns 2 | np 4 ns 2 np | 5 ns 2 np | 6 1 st medlem av gruppen |
| Vær < C N O | F | He | Felles oksidasjonsnummer | +3 | +4 | +5 |
| -2 | -1 | 0 | Andre oksidasjonstilstander | +1 | +2, -4 | +3, -3 |
| +4, +2, | +3, +5, + 1, +7 | - | Egenskaper: | S-blokkelementer: | Generelt er alle s-blokkelementene metaller. De er skinnende, gode elektriske og varmeledere og enkle å fjerne elektroner fra valensskall. De er de mest reaktive elementene i det periodiske bordet. | P-blokkelementer: |
De fleste av p-blokkelementene er ikke-metaller. De har lave kokepunkter, dårlige ledere og vanskelig å fjerne elektroner fra det ytre skallet. I stedet får de elektroner. Noen av de ikke-metaller er faste stoffer (C, P, S, Se) ved romtemperatur mens noen er gasser (oksygen, nitrogen). Brom er et ikke-metall, og det er en væske ved romtemperatur.
I tillegg inneholder p-blokk noen metalliske elementer; aluminium (Al), gallium (Ga), indium (In), tinn (Sn), tallium (Tl), bly (Pb) og vismut (Bi). Image Courtesy:
1. "Periodisk tabell (polyatomisk)" av DePiep [CC BY-SA 3. 0] via Commons 2. "Periodisk tabellblokker spdf (32 kolonne)" av Bruker: DePiep [CC BY-SA 3. 0] via Commons