Forskjell mellom delvis trykk og damptrykk Forskjellen mellom
Delvis trykk og damptrykk er ofte brukt vitenskapelige termer knyttet til mengden av trykket som utøves av systemkomponenter, men deres identitet kan være forvirrende for andre. Det er et klart skille mellom disse betingelsene, inkludert deres effekter og identitet. Denne artikkelen vil utdype mer om forskjellene mellom disse betingelsene. Det vil også inkludere noen eksempler for å demystifisere applikasjonene derav.
La oss starte med å markere trykkbegrepet før vi kan dykke inn i forskjellen mellom damp og partialtrykk. Trykket er vitenskapelig definert som kraften som påføres per areal på et objekt eller et stoff. Det kan også defineres som kraften som brukes av de kolliderende partiklene på hverandre, og det måles ofte ved bruk av Pascal. Ved kollisjon av partikler benyttes gassekvasjon og kinetisk teori for gasser for å beregne trykket.
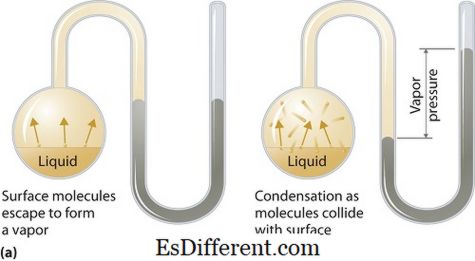
Hva er damptrykk?
Damptrykk kan gjelde for flytende eller faste faser. Det er trykket som dampen utøver i sin termodynamiske likevekt på dens flytende eller faste tilstand ved en gitt temperatur i et lukket system når både dampen og væsken (faststoffet) er i kontakt. Dette trykket oppstår som et resultat av fordampning, som aktiveres av en økt varme på det faste stoffet eller væsken. Dermed benyttes temperaturen som mål for fordampning, og den er direkte proporsjonal med damptrykket. Dette betyr at jo høyere temperaturen er, desto høyere er damptrykket.
Under fordampningen unnslipper luftmolekylene som følge av den høyere kinetiske energien til luften i et lukket system. Deretter oppstår damptrykket mellom dampen og dens kondenserte form av væske (fast) når den er i likevekt. I løsninger der de intermolekylære kreftene er svakere, har damptrykket tendens til å være mer, og omvendt, i løsninger der de intermolekylære kreftene er sterkere, er damptrykket mindre.
Damptrykket kan også forekomme i ideelle blandinger som forklart av Raoults lov. Det står at partisk damptrykk av en bestemt komponent i en flytende eller fast blanding er lik damptrykket av komponenten multiplisert med dens molfraksjon i den blandingen ved en gitt temperatur. Eksempelet nedenfor illustrerer det.
Eksempel 1.
Gitt en ideell blanding av 0,5 mol. etanol og 1,5 mol. metanol med damptrykket på henholdsvis 30KPa og 52KPa, bestemmer partiell damptrykk av hver komponent.
Løsning:
Totalt antall mol er 1. 5mol + 0. 5mol = 2. 0mol. I henhold til Raoults lov er partiell damptrykk lik damptrykket multiplisert med den molære fraksjon av den spesielle komponenten.I dette tilfellet er P metanol = 1 5/2 * 52 = 39KPa og P etanol = 0,5-2 * 30 = 7,5KPa.
Når du har delvis damptrykk av komponentene i blandingen, kan du få det totale damptrykket ved å legge dem sammen. I denne forbindelse gir 7,5 + 39 46, 5KPa totalt damptrykk av blandingen av etanol og metanolløsninger.
Faktorer som påvirker damptrykket
Molekyleridentitet
Som allerede nevnt ovenfor, bestemmer molekylkreftene mengden damptrykk som skal utøves. Hvis kreftene er sterkere, oppstår mindre damptrykk, og hvis svakere, oppstår mer damptrykk. Derfor vil sammensetningen av væsken eller faststoffet påvirke damptrykket.
Temperatur
Høyere temperatur fører til høyere damptrykk fordi det aktiverer mer kinetisk energi for å bryte de molekylære kreftene, slik at molekylene raskt kan unnslippe væskeoverflaten. Når damptrykket (mettet damptrykk) tilsvarer det ytre trykket (atmosfærisk trykk), vil væsken begynne å koke. En lavere temperatur vil resultere i lavt damptrykk, og det vil ta tid for væsken å koke.

Daltons lov om delvis trykk
Hva er partialtrykk?
Ideen om delvis trykk ble først foreslått av den anerkjente forskeren John Dalton. Det fødte sin delpreslove som sier at det totale trykket som utøves av en ideell blanding av gasser, er lik summen av partialtrykket av enkelte gasser. Si at en bestemt beholder er fylt med hydrogen-, nitrogen- og oksygengasser, det totale trykket, P TOTAL, vil være lik summen av oksygen, nitrogen og hydrogen. Partialtrykket av en hvilken som helst gass i den blandingen beregnes ved å multiplisere det totale trykket med den molære fraksjon av den enkelte gass.
I et nøtteskall er partialtrykk trykket som utøves av en bestemt gass i blandingen som om den opptrer alene i systemet. Dermed ignorerer du andre gasser når du bestemmer partialtrykket av en enkelt gass. Denne teorien kan verifiseres ved å injisere, si 0. 6atm O 2 i en 10. 0 L beholder ved en 230 K og injiser deretter 0. 4atm N 2 i en identisk beholder av samme størrelse ved samme temperatur, og deretter til slutt kombinere gassene for å måle det totale trykket; det vil være summen av de to gassene. Dette forklarer tydelig delvis trykket av en enkelt gass i en blanding av ikke-reaktive gasser.
Beregning av partialtrykket
For å beregne partialtrykket er en absolutt bris da Daltons lov [1] gir bestemmelser for det. Det vil avhenge av den typiske informasjonen som tilbys. Hvis for eksempel det totale trykket er gitt for en blanding av gass A og B så vel som trykket av gass A, kan partialtrykket av B beregnes ved bruk av P TOTAL = P A + P B . Resten er algebraiske manipulasjoner. Men i et tilfelle der bare det totale trykket i blandingen er gitt, kan du bruke molar fraksjonen av gass B for å bestemme er delvis trykk.Den molære fraksjon, betegnet med X, kan bli funnet ved å dele molene av gass B med de totale molene av gassblandingen. Deretter for å finne partialtrykket, vil du multiplisere den molære fraksjonen, X, med det totale trykket. Eksemplet nedenfor fordyper det.
Eksempel 2.
En blanding av nitrogen og oksygen med henholdsvis 2, 5 mol og 1,85 mol injiseres i en 20 0 liter beholder med et totalt trykk på 4atm; beregne partialtrykket som utøves av oksygengassen.
Løsning:
Totalt antall mol i blandingen er 2. 5 + 1. 85 = 4. 35 mol. Så vil molarfraksjonen av oksygen, X o , være 1,85 mol / 4. 35 mol = 0,42 mol. Partialtrykket av oksygen vil være 0. 425 * 4atm = 1. 7atm. Partialtrykket av gjenværende gass kan beregnes etter samme tilnærming eller kan beregnes ved å bruke oksygengassen og det totale trykket som utarbeidet av Dalton's partialtrykkslov at totaltrykket av ikke-reaktive gasser er lik summen av de delvise pressene.
Forskjellen mellom damp og partialtrykk
Det er tydelig at damptrykk og partialtrykk er to forskjellige trykk fra ovenstående forklaringer. Damptrykk gjelder i flytende og faste faser mens partialtrykket gjelder på gassfasen. Damptrykket utøves i faseovergang etter at tilstrekkelig varme er tilsatt til oppløsningen og dermed fører til at dets molekyler unnslipper i et lukket system.
Hovedforskjellen mellom partialtrykk og damptrykk er at partialtrykk er trykket som utøves av en enkelt gass i en blanding som om den var alene i det systemet, mens damptrykket refererer til trykket som utøves av dampen i dets termodynamisk likevekt med dens kondenserte tilstand av flytende eller fast stoff. Tabellen under gir en kort sammenligning av disse trykkene.
| Damptrykk | Delvis trykk |
| Den utøves av væske eller fast damp i dens kondenserte fase i likevekt | Den utøves av individuelle gasser i en ikke-reaktiv gassblanding |
| Godt forklart av Raoults Lov | Godt forklart av Daltons lov |
| Gjelder i faste og flytende faser | Gjelder kun i gassfaser |
| Uavhengig av overflateareal eller volum av systemet | Beregnet ved bruk av gassene i samme volum |
| Beregnet ved bruk av molfraksjonen av løsningen | Beregnet ved bruk av molfraksjonen av gassen |
Wrap Up!
Damptrykk og partialtrykk er to viktige vitenskapelige termer som brukes til å bestemme effekten av de kreftene som påføres henholdsvis dampen og gassen, i gitt lukket system ved bestemte temperaturer. Deres viktigste forskjell er applikasjonsområdet med damptrykk påføres i flytende eller faste faser, mens partialtrykket påføres på en enkelt gass i en blanding av ideelle gasser i et gitt volum.
Deltrykket beregnes enkelt ved å følge Daltons lov om delvis trykk, mens damptrykket beregnes ved å anvende Raoults lov.I en gitt blanding utøver hver gasskomponent sitt eget trykk, som kalles partialtrykket, uavhengig av andre gasser. Og når du dobler molene av en hvilken som helst komponent, mens temperaturen forblir konstant, vil du øke partialtrykket. Ifølge Clausius-Clapeyron-forholdet [2] øker damptrykket etter hvert som temperaturen øker.
Med ovennevnte opplysninger, bør du kunne skille mellom damptrykk og partialtrykk. Du bør også kunne beregne dem ved hjelp av de molære fraksjonene og multiplisere med det totale trykket. Vi har gitt deg typiske eksempler for å utdype på bruken av disse pressene.


