Forskjell mellom Hydroxyl og Hydroxide | Hydroxyl vs Hydroxide
Nøkkelforskjellen - Hydroxyl vs Hydroxid
De to uttrykkene hydroksyl og hydroksyd høres veldig like siden begge har to lignende atomer, oksygen (O = 16) og hydrogen (H = 1). Hydroksid er en negativ ion med en enkelt ladning og hydroksyl er ikke funnet i sin frie form, den er en del av et annet molekyl eller ion. Hydroksidioner er mer reaktive enn hydroksylgruppen i et molekyl. Dette er nøkkelforskjellen mellom hydroksyl og hydroksid.
Hva er Hydroxyl?
Hydroksyl er en nøytral forbindelse, og den er den tilsvarende elektrisk nøytale forbindelsen av hydroksidion. Den frie formen av hydroksyl (• HO) er en radikal og når den er bundet kovalent til andre molekyler, betegnes den som hydroksyl (-OH) -gruppen. Hydroksylgrupper kan virke som nukleofiler, og hydroksylradikal brukes som katalysator i organisk kjemi. Hydroksylgrupper er ikke sterkt reaktive som de andre nukleofiler. Imidlertid er de tilretteleggerne i dannelsen av sterke intramolekylære krefter kalt "hydrogenbindinger".

Hva er Hydroxid?
Hydroksid er en diatomisk anion som inneholder et oksygenatom og et hydrogenatom. Bindingen mellom oksygen og hydrogenatom er kovalent og dens kjemiske formel er OH - . Selv ionisering av vann produserer hydroksylioner og derfor er hydroksylioner en naturlig del i vannet. Hydroksidioner benyttes som en base, en ligand, en nukleofil og en katalysator i kjemiske reaksjoner. I tillegg produserer hydrogenioner salter med metallkationer, og de fleste av dem dissocierer i vandige oppløsninger og frigjør solvatiserte hydroksidioner. Mange uorganiske kjemiske stoffer inneholder begrepet "hydroksyd" i deres navn, men de er ikke ioniske og de er kovalente forbindelser som inneholder hydroksylgrupper.

Hva er forskjellen mellom Hydroxyl og Hydroxid?
Struktur:
Hydroksyl: Hydroksyl er en elektrisk nøytral forbindelse som kan finnes på to måter, som den radikale og den kovalent bundet form.

Hydroksylradikal Når det er kovalent bundet til et molekyl
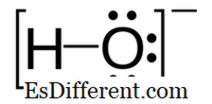
Hydroksid: Hydroksid er en negativt ladet ion og den negative ladningen er på oksygenatomet.
Hydroksyl: Hydroxylgrupper finnes i mange organiske forbindelser; alkoholer, karboksylsyrer og hydroksylgrupper som inneholder sukker. Forbindelser inneholdende hydroksylgrupper som vann, alkoholer og karboksylsyrer kan enkelt deprotoneres.I tillegg er disse hydroksylgruppene engasjert i dannelsen av hydrogenbindinger. Hydrogenbindinger hjelper molekylene til å holde seg sammen, og dette fører til besittelse av høyere kokende og smeltepunkt. Generelt er organiske forbindelser dårlig vannoppløselige; Disse molekylene blir litt vannløselige når de inneholder to eller flere hydroksylgrupper.
Hydroksid: De fleste kjemikaliene som inneholder hydroksid, anses å være svært ætsende, og noen er svært skadelige. Når disse kjemikaliene er oppløst i vann, virker hydroksidionen som en utrolig sterk base. Siden hydroksidion bærer en negativ ladning, blir den ofte bundet til positivt ladede ioner.
Noen ioniske forbindelser som inneholder hydroksydgrupper i molekylet, oppløser seg veldig godt i vann; korrosive baser som natriumhydroksyd (NaOH) og kaliumhydroksyd (KOH) kan tas som eksempler. Imidlertid er noen andre hydroksydholdige ionforbindelser litt uoppløselige i vann; eksempler er kobber (II) hydroksyd [Cu (OH) 2 - lyseblå farget] og jern (II) hydroksyd [Fe (OH) 2 - brun].
Reaktivitet:
Hydroxyl : Hydroxylgrupper er mindre reaktive sammenlignet med hydroksydgruppen. Men, hydroksylgrupper danner lett hydrogenbindinger og bidrar til å gjøre molekyler mer oppløselige i vann.
Hydroksylradikaler er imidlertid svært reaktive og meget nyttige i organiske kjemiske reaksjoner.
Hydroksid: Hydroksid (OH - ) -gruppen betraktes som en sterk nukleofil i organisk kjemi.
Referanser: Martin. Chaplin @ btinternet. com, M.C. (n. d.). Hydroksidioner. Hentet 28. desember 2016, herfraHydroxid-ion: Definisjon og formel - Video og leksjonstrykk. (n. d.). Hentet 28. desember 2016, herfra Hydroxid. (n. d.). Hentet 28. desember 2016, herfra Hydroksygruppe. (n. d.). Hentet 28. desember 2016, herfra Hydroxylgruppe: Definisjon, struktur og formel. (n. d.). Hentet 28. desember 2016, herfra H. (2014). Hva er en Hydroxyl-gruppe? Hentet 28. desember 2016, herfra


