Forskjell mellom hydrolyse og kondensasjon
Hydrolyse vs kondensering
Kondensasjon og hydrolyse er to typer kjemiske reaksjoner, som er involvert i bindingsdannelse og bindingsbrudd. Kondensasjon er omvendt av hydrolyse. Disse to typer reaksjonene finnes ofte innenfor biologiske systemer, og vi bruker også disse reaksjonene for å oppnå mange kommersielt viktige produkter.
Kondensering
Kondensasjonsreaksjoner er en type kjemisk reaksjon hvor små molekyler kommer sammen for å danne et stort enkeltmolekyl. Reaksjonen foregår i to funksjonelle grupper i molekylene. Et annet karakteristisk trekk ved kondensasjonsreaksjon er at et lite molekyl går tapt under reaksjonen. Dette molekylet kan være vann, hydrogenklorid, eddiksyre, etc. Hvis det tapte molekylet er vann, er disse typer kondensasjonsreaksjoner kjent som dehydreringsreaksjoner. Siden reaktantmolekylene er mindre og produktmolekylet er svært stort, vil densiteten av produkter alltid være høyere enn reaksjonene i kondensasjonsreaksjoner. Kondensasjonsreaksjoner finner sted på flere måter. For eksempel kan vi i stor grad dele disse i to typer som intermolekylære kondensasjonsreaksjoner og intra-molekylære kondensasjonsreaksjoner. Hvis de to funksjonelle gruppene er bosatt i samme molekyl, er de kjent som intra-molekylære kondensasjoner. For eksempel har glukose en lineær struktur som følger.
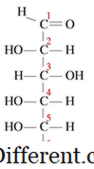
I en løsning er flertallet av molekylene i en syklisk struktur. Når en syklisk struktur dannes, blir -OH på karbon 5 omdannet til eterbindingen for å lukke ringen med karbon 1. Dette danner en seks-medlems hemiacetal ringstruktur. Under denne intramolekylære kondensasjonsreaksjon avstøtes en vannmolekyl, og en eterbinding dannes. Intermolekylære reaksjoner produserer mange nyttige og vanlige produkter. Under dette finner reaksjonen sted mellom funksjonelle grupper av to separate molekyler. For eksempel, når man danner en makromolekyl som protein, kondenseres aminosyrer. Et vannmolekyl frigjøres, og en amidbinding dannes som er kjent som en peptidbinding. Når to aminosyrer bindes sammen, dannes et dipeptid, og når mange aminosyrer er sammenkalt, kalles det et polypeptid. DNA og RNA er også to makromolekyler dannet som følge av kondensasjonsreaksjoner mellom nukleotider. Kondensasjonsreaksjoner produserer svært store molekyler og noen ganger er molekylene ikke så store. For eksempel: i esterifiseringsreaksjonen mellom en alkohol og en karboksylsyre, dannes et lite estermolekyl dersom det dannes. Kondensasjon er viktig ved polymerdannelse. Polymerer er store molekyler, som har samme strukturelle enhet som gjentas igjen og igjen.De gjentatte enhetene kalles monomerer. Disse monomerene er bundet til hverandre med kovalente bindinger for å danne en polymer.
Hydrolyse
Dette er en reaksjon der en kjemisk binding brytes ved hjelp av et vannmolekyl. Under denne reaksjonen sprer et vannmolekyl opp i en proton og en hydroksidion. Og da blir disse to ionene lagt til de to delene av molekylet hvor bindingen er ødelagt. For eksempel er følgende en ester. Esterbindingen er mellom -CO og -O.

I hydrolysen legger protonen fra vannet til -O siden, og hydroksidjonen legger til -CO-siden. Derfor vil det som et resultat av hydrolysen dannes en alkohol og en karboksylsyre som var reaktantene ved dannelse av esteren.
|
Hva er forskjellen mellom hydrolyse og kondensasjon? • Hydrolyse er motsatt av kondensering. • Kondensasjonsreaksjoner gjør kjemiske bindinger mens hydrolysen bryter opp kjemiske bindinger. • Polymerer er laget av kondensasjonsreaksjoner, og de brytes av hydrolysereaksjoner. • Under kondensreaksjoner kan vannmolekyl frigjøres. I hydrolysereaksjonene er vannmolekyl inkorporert i molekylet. |




