Forskjell mellom etanol og etansyre | Etanol vs etansyre
Nøkkelforskjell - Etanol vs Etansyre
Selv om etanol og etansyre har lignende navn, kan man se en nøkkelforskjell mellom dem, da de er to forskjellige organiske forbindelser som inneholder to forskjellige funksjonelle grupper. Etanol er nest enkleste medlem av alkoholfamilien mens etansyre er det nest enkleste medlemmet av karboksylsyregruppen. De inneholder begge bare to karbonatomer i tillegg til den funksjonelle gruppen som er tilstede i molekylet. Når vi sammenligner kjemiske egenskaper begge er brukt som organiske løsningsmidler og har en karakteristisk lukt. I motsetning er etansyre surere enn etanol.
Hva si Etanol ?
Det vanlige navnet på etanol er etylalkohol . Dens funksjonelle gruppe er en hydroksylgruppe (-OH gruppe). Alle kjemiske egenskaper som reaktivitet, surhet eller basicitet avhenger av funksjonsgruppen. Etanol har en veldig mild lukt, og det er en flyktig forbindelse. Etanol er svært viktig i sine industrielle anvendelser; Det er et trygt løsemiddel, en drivstoffkilde, som brukes til å produsere medisiner og kosmetikk, og det er hovedkomponenten i alkoholholdige drikker. Etanol kan produseres innenlands ved bruk av jordbruksavfall som mais, sukkerrør eller gress.

Hva er etan syre ?
Det mest brukte navnet på etansyre er eddiksyre . Det er en fargeløs væske med en karakteristisk sur smak og skarp lukt. Den har molekylformelen av CH 3 COOH. Den ufortynnede form av etansyren kalles "iseddik" og omtrent 3-9% volumsyre brukes til å lage eddik. Etansyre regnes som en svak syre; men det er etsende og kan angripe huden.
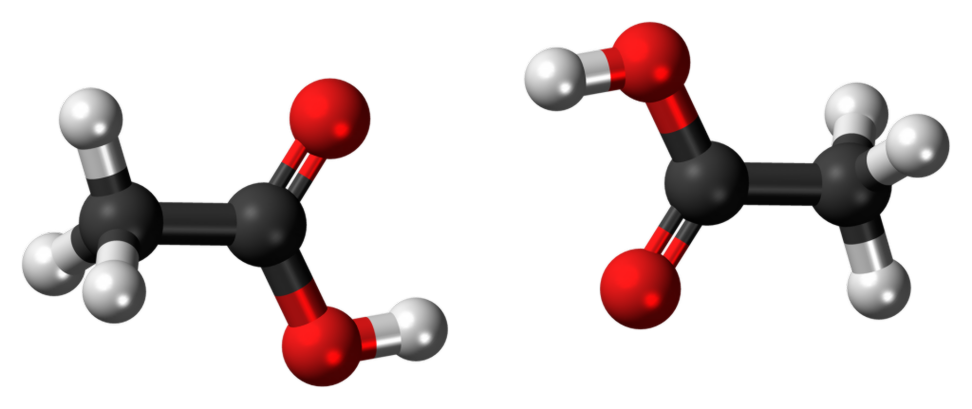
Hva er forskjellen mellom etanol og etansyre?
Egenskaper for etanol og etansyre:
Funksjonsgruppe:
Etanol: Hydroksylgruppe (-OH gruppe) er funksjonell gruppe i etanol. Det er den karakteristiske egenskapen til alkoholer. Alle alkoholer har minst en -OH gruppe i sin struktur.
Etansyre: Funksjonsgruppen i etansyre er en -COOH-gruppe. Det er vanlig for alle karboksylsyrer.
Egenskaper:
Etanol: Etanol er en enverdig alkohol med en søt lukt som koke ved 78. 5 ° C. Det er det eneste hydrokarbonet som oppløses i vann i alle proporsjoner.Etanol reagerer med alkalisk KMnO4 for å gi etansyre mens etansyre ikke reagerer med alkalisk KMnO4.
Etansyre: Det er en svak monoprotisk syre i vandig oppløsning (pKa = 4, 76). Flytende eddiksyre er et polært løsningsmiddel som vann. Den løser både polare væsker som sukker og salter, og ikke-polare væsker som oljer og elementer som svovel og jod. Den er lett og fullstendig blandbar med vannkloroform og heksan. Eddiksyre har en sterk skarp lukt.
Bruk:
Etanol: Etanol er til stede i alkoholholdige drikkevarer og brukes også som biobrensel for biler. Det er et godt løsningsmiddel som kan oppløse mange organiske løsninger som er uoppløselige i vann. Etanol brukes til å produsere mange parfymer, kosmetikk og lakk i malingsindustrien.
Etanol som drivstoff:
CH 3 CH 2 OH + 3O 2 → 2CO 2 + 3H 2 O
Etansyre: Eddiksyre brukes som et kjemisk reagens for å produsere andre kjemikalier. Det brukes i større mengder for å produsere vinylacetatmonomer; Vinylacetat kan polymeriseres for å produsere polyvinylklorid eller andre polymerer. I tillegg benyttes eddiksyre til å produsere estere som brukes i blekk, malerier og belegg. Eddiksyreanhydrid er en annen viktig kjemisk forbindelse som kan syntetiseres ved kondensering av to molekyler eddiksyre. En liten mengde etansyre brukes til å produsere husholdningseddik.
Syrlighet:
Etanol: Etanol reagerer heller ikke med natriumbikarbonat (NaHCO3) eller endrer fargen på et blått litmuspapir. Derfor er det mindre surt enn etansyre.
Etansyre: Etansyre er en svak syre som reagerer med natriumbikarbonat (NaHCO3) som frigjør CO2-gass. Det blir også blå litmus i rødt.
Image Courtesy: "Etanol-3D-baller". (Public Domain) via Wikimedia Commons "Eddiksyre dimer 3D ball" av Jynto (talk) - Eget arbeid. (CC0) via Wikimedia Commons