Forskjell mellom EDTA og EGTA
EDTA vs EGTA
EDTA og EGTA begge er chelaterende midler. Begge er polyaminokarboksylsyrer og har mer eller mindre de samme egenskapene.
EDTA
EDTA er det forkortede navnet for etylendiamintetraeddiksyre. Det er også kjent som (etylendinitrilo) tetraeddiksyre. Følgende er strukturen av EDTA.
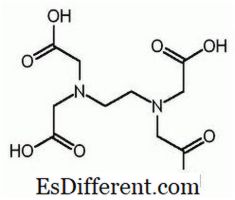
EDTA-molekylet har seks steder hvor en metallion kan bindes. Det er to aminogrupper og fire karboksylgrupper. De to nitrogenatomene i aminogruppene har et ubrent elektronpar i hver. EDTA er en heksadentatligand. Det er også et chelateringsmiddel på grunn av evnen til å sekvestrere metallsioner. EDTA danner chelater med alle kationer, bortsett fra alkalimetaller, og disse chelater er tilstrekkelig stabile. Stabiliteten kommer fra de flere kompleksdannelsesstedene i molekylet som gir opphav til en burlignende struktur som omgir metallionen. Dette isolerer metalljonen fra løsningsmiddelmolekyler, og dermed forhindrer solvasjon. Karboksylgruppen av EDTA kan dissociere donerende protoner; EDTA har derfor sure egenskaper. De forskjellige EDTA-artene forkortes som H 4 Y, H 3 Y - , H 2 Y 2-, HY3 - og Y 4- . Ved meget lav pH (surt medium) er den protonerte form av EDTA (H 4 Y) overveiende. I motsetning til dette, ved høy pH (grunnmedium), dominerer fullstendig deprotonert form (Y 4- ). Og når pH endrer seg fra lav pH til høy pH, dominerer andre former for EDTA i visse pH-verdier. EDTA er tilgjengelig som full protonert form eller enten saltform. Dinatrium EDTA og kalsiumdinatrium EDTA er de vanligste saltformene som er tilgjengelige. Den frie syre H 4 Y og dihydratet av natriumsaltet Na 2 H 2 Y. 2H 2 O er kommersielt tilgjengelig i reagenskvalitet.
EGTA EGTA er den forkortede termen for etylenglykoltetraeddiksyre. Det er et chelateringsmiddel, og ligner veldig mye på EDTA.EGTA har høyere affinitet for kalsiumioner enn magnesiumioner. EGTA har følgende struktur.
I likhet med EDTA har EGTA også fire karboksylgrupper, som kan produsere fire protoner ved dissosiasjon. Det er to amingrupper, og de to nitrogenatomene i aminogruppene har udelte elektronpar i hver. EGTA kan brukes som en buffer for å ligne pH i en levende celle. Denne egenskapen til EGTA tillater bruken i Tandem Affinity Purification, som er en proteinrensingsteknikk.

Hva er forskjellen mellom




