Forskjell mellom karboksylsyre og ester
karboksylsyre mot Ester
Karboksylsyrer og estere er organiske molekyler med gruppen -COO. Et oksygenatom er bundet til karbon med en dobbeltbinding, og det andre oksygen er bundet med en enkeltbinding. Siden bare tre atomer er koblet til karbonatomet, har den en trigonal plan geometri rundt den. Videre er karbonatomet sp 2 hybridisert. Karboksylgruppe er en allment forekommende funksjonell gruppe innen kjemi og biokjemi. Denne gruppen er forelder av beslektede familie av forbindelser kjent som acylforbindelser. Acylforbindelser er også kjent som karboksylsyrederivater. Ester er et karboksylsyrederivat sånn.
Karboksylsyre
Karboksylsyrer er de organiske forbindelser som har funksjonell gruppe -COOH. Denne gruppen er kjent som karboksylgruppen. Karboksylsyre har en generell formel som følger.
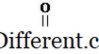
I den enkleste typen karboksylsyre er R-gruppen lik H. Denne karboksylsyre er kjent som myresyre. Til tross for maursyre er det mange andre typer karboksylsyrer med forskjellige R-grupper. R-gruppen kan være en rett karbonkjede, forgrenet kjede, aromatisk gruppe, etc. Eddiksyre, heksansyre og benzosyre er noen av eksemplene for karboksylsyrer. I IUPAC-nomenklaturen er karboksylsyrer kalt ved å slippe den endelige e av navnet på alkanen som tilsvarer den lengste kjeden i syren og ved å legge til -syre. Alltid er karboksylkarbonen tildelt nummer 1. I henhold til dette er IUPAC-navnet for eddiksyre etansyre. Annet enn IUPAC-navnene, har mange karboksylsyrer vanlige navn.
Karboksylsyrer er polære molekyler. På grunn av -OH-gruppen kan de danne sterke hydrogenbindinger med hverandre og med vann. Som et resultat har karboksylsyrer høyt kokepunkt. Videre oppløses karboksylsyrer med lavere molekylvekter enkelt i vann. Imidlertid, ettersom lengden av karbonkjeden øker, reduseres oppløseligheten. Karboksylsyrer har en surhet som spenner fra pKa 4-5. Siden de er sure, reagerer de lett med NaOH og NaHCO 3 løsninger for å danne oppløselige natriumsalter. Karboksylsyrer som eddiksyre er svake syrer, og de eksisterer i likevekt med dens konjugatbase i vandige medier. Imidlertid, hvis karboksylsyrene har elektronuttakende grupper som Cl, F, er de sure enn den usubstituerte syre.
Ester
Estere har en generell formel for RCOOR '. Estere fremstilles ved reaksjonen mellom en karboksylsyre og en alkohol. Estere er oppkalt ved å skrive navnene på den avledede alkohol først. Deretter er navnet som er avledet fra syredelen, skrevet med slutten - spilt eller - oate.For eksempel er etylacetat navnet på den følgende esteren.

Estere er polære forbindelser. Men de har ikke muligheten til å danne sterke hydrogenbindinger til hverandre på grunn av mangel på hydrogen begrenset til oksygen. Som et resultat har estere lavere kokepunkter sammenlignet med syrer eller alkoholer med lignende molekylvekter. Ofte har estere en behagelig lukt, som er ansvarlig for å produsere karakteristiske lukter av frukt, blomster etc.
|
Hva er forskjellen mellom karboksylsyre og ester ? • Estere er karboksylsyrederivater. • Karboksylsyrer har en generell formel for RCOOH. Estere har en generell formel for RCOOR '. • Karboksylsyrer kan lage sterke hydrogenbindinger, men estere kan ikke. • Kokepunktene til estere er lavere enn karboksylsyrer. • Sammenlignet med syrer med lavere molekylvekt, har estere ofte behagelige lukt. |




