Forskjell mellom ammoniumnitrat og urinstof
Ammoniumnitrat vs urinstof
Forbindelser som inneholder nitrogen er ofte brukt som gjødsel fordi nitrogen er et av de svært essensielle elementene for plantevekst og utvikling. Ammoniumnitrat og urea er slike nitrogenholdige faste stoffer.
Ammoniumnitrat
Ammoniumnitrat har kjemisk formel av NH 4 NO 3 . Dette er nitrat av ammoniakk, og den har følgende struktur.

Ved romtemperatur og standardtrykk finnes ammoniumnitrat som et luktfritt, hvitt krystallinsk faststoff. Dette er et surt salt med en pH på ca. 5. 4. Den molare massen er 80. 052 g / mol. Smeltepunktet av ammoniumnitrat er ca. 170 ° C og det dekomponerer ved oppvarming til ca. 210 o C. Ammoniumnitrat brukes primært til landbruksformål. Den er rik på nitrogen, så det brukes som gjødsel, for å gi nitrogen til planter. Siden direkte kontakt med kjemikalier ikke er farlig og giftighet er mindre, er det fordelaktig å bruke som gjødsel. Videre forårsaker oppvarming eller tenning at ammoniumnitrat eksploderer. Derfor brukes den som et oksidasjonsmiddel i eksplosiver. På grunn av denne eksplosive naturen, bør vi være ekstra forsiktig når vi lagrer ammoniumnitrat. Ammoniumnitrat er stabilt, men når det er i smeltet tilstand, er eksplosjonsfaren høyere. Risikoen øker hvis det kommer til kontakt med oksiderbare materialer som olje, diesel, papir, fille eller halm. Produksjon av ammoniumnitrat er en enkel kjemisk reaksjon. Når salpetersyre reageres med ammoniakkvæske, produseres ammoniumnitrat i oppløsningsformen. Industrielt konsentrert salpetersyre og ammoniakkgass brukes til produksjon. Siden dette er en svært eksoterm og voldelig reaksjon, er det utfordrende å produsere det i stor skala. Å være et salt, er ammoniumnitrat meget løselig i vann. Derfor, når den brukes som gjødsel, kan den vaskes av og akkumuleres i vannlegemer. Dette kan være en dødelig tilstand for vannlevende liv.
Urea Urea har molekylformelen av CO (NH
2 ) 2 og den følgende struktur. Det er et karbamid med funksjonell gruppe C = O. To NH
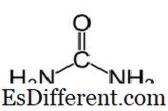
2 -grupper er bundet til karbonylkarbonet fra to sider. Urea blir naturlig produsert i pattedyr i nitrogen metabolisme. Dette er kjent som ureasyklusen, og oksydasjon av ammoniakk eller aminosyrer produserer urea inne i kroppen vår. Det meste av urea utskilles gjennom nyrer med urin, mens noen utskilles med svette. Den høye vannoppløseligheten av urea er nyttig når det skilles ut fra kroppen. Urea er et fargeløst, luktfritt fast stoff, og det er giftfritt. Annet enn å være et metabolsk produkt, er det hovedsakelig å produsere gjødsel.Urea er en av de vanligste nitrogenutslippende gjødselene, og den har et høyt nitrogeninnhold sammenlignet med andre faste nitrogenholdige gjødselstoffer. I jord omdannes urea til ammoniakk og karbondioksid. Denne ammoniakk kan omdannes til nitritt med jordbakterier. Videre brukes urea til å produsere eksplosiver som urea nitrat. Det brukes også som råmateriale til å produsere kjemikalier som plast og lim.