Forskjell mellom alkalinitet og grunnleggende | Alkalinitet vs grunnleggende
Hovedforskjell - Alkalinitet vs Basicitet
De to begrepene "alkalinitet" og "basicitet" er ganske forvirrende. De fleste av folkene vet at det er forskjell mellom disse to parametrene, men bare noen få av dem er i stand til å definere det riktig. nøkkelforskjellen mellom disse to begrepene er best forklart i sine definisjoner. Basis er et mål som direkte avhenger av pH-skalaen og alkalinitet er hvor mye syre er nødvendig for å senke pH til en signifikant syreverdi ; det er også kjent som bufferkapasitet for en vannkropp . Med andre ord varierer pH-verdien av basisløsninger fra 7-14; der løsningene med høye pH-verdier er mer grunnleggende. Begge har flere definisjoner, men den generelle ideen er lik.
Hva er Alkalinitet?
Alkalinitet er en av de viktigste parametrene i akvatiske kropper, og det er svært viktig for vannlevende organismer . Alkalinitet måler vannkroppers evne til å nøytralisere syrer og baser. Med andre ord er det bufferkapasiteten til en vannkropp for å opprettholde pH-verdien til en forholdsvis stabil verdi. Vann som inneholder bikarbonater (HCO 3 - ), karbonater (CO 3 2- ) og hydroksyder (OH - ) er en god buffer; De kan kombinere med H + ioner i vann for å øke pH (blir mer grunnleggende) av vannet. Når alkaliteten er for lav (bufferkapasiteten er lav), syrer som tilsettes vannkroppen, senker pH til en høyere sur verdi.
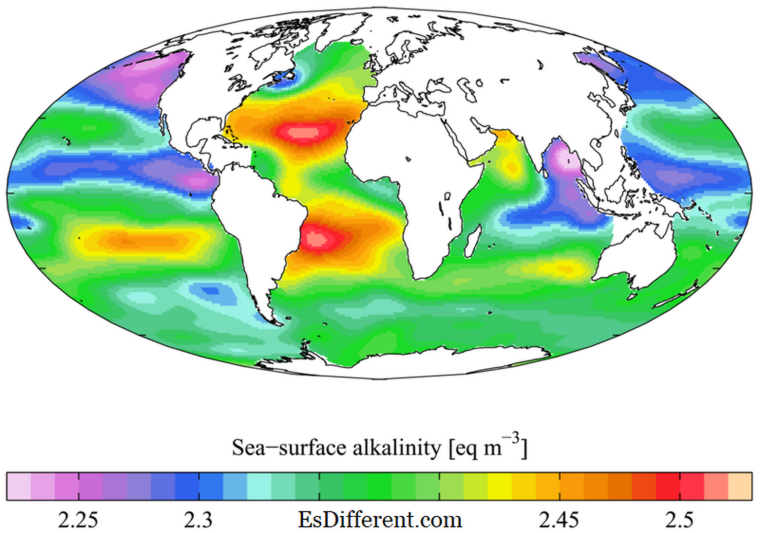
Basicitet er en egenskap av baser, målt i pH-skala . Baser er forbindelsene som inneholder pH over 7; fra pH = 8 (mindre grunnleggende) til pH = 18 (mer grunnleggende). Grunnleggende innhold av en forbindelse kan defineres på tre forskjellige måter. Ifølge Arrhenius-teorien er baser substansene som dissocierer i vandig medium som produserer OH - -ioner. I Bronsted-Lowry-teorien kalles protonacceptorer baser. Ifølge Lewis-teorien kalles et elektronpar-donor en base. Grunnleggende er styrken ionisering for å produsere OH - ioner, evne til å akseptere protoner eller evne til å donere elektroner.

Thomas Martine Lowry - Bronsted-Lowry Theory
Hva er forskjellen mellom Alkalinitet og Basicitet?
Definisjon av Alkalinitet og Basicitet:
Alkalinitet: Flere definisjoner er der.
Alkalinitet er den sure nøytraliserende kapasiteten til oppløsninger i en vannprøve målt i milliekvivalenter per liter.
Summen av titrerbare karbonat- og ikkekarbonatkjemikalier i en filtrert vannprøve.
Vannets kapasitet til å nøytralisere en syreoppløsning.
Bufferkapasiteten til vann for å opprettholde en relativt stabil pH, uten å endre pH-verdien, når syre tilsettes.
Grunnleggende: Tre teorier brukes til å definere surhet og basicitet.
Arrenhius: Baser er arten som ioniserer for å produsere OH - i vann. Grunnleggende øker etter hvert som de ioniserer mer, og gir OH - i vann.
Bronsted-Lowry: Proton (H + ) akseptorer kalles baser.
Lewis: Elektronpar donorer kalles baser.
Faktorer som påvirker alkalinitet og grunnleggende:
Alkalinitet: Alkalinitet er ikke avhengig av pH-verdien; Vannlegemer kan ha enten lavere (meget sur) eller høyere (grunnleggende) pH-verdi med høyere verdi for alkalinitet. Alkalinitet bestemmes av flere faktorer som bergarter, jord, salter og visse industrielle aktiviteter (avløpsvann som inneholder såpe og vaskemidler er alkaliske) av mennesker. For eksempel er områdene hvor kalkstein (CaCO 3 ) er betydelig tilgjengelig, mer alkalisk vann.
Grunnleggende: Faktorer som påvirker basisiteten av en forbindelse varierer avhengig av definisjonen av basiciteten. For eksempel avhenger elektronparets tilgjengelighet av en base av tre faktorer.
Elektronegativitet : CH3-> NH2-> HO-> F-
Når man vurderer atomer i samme rad i periodisk tabell, har det mest elektronegative atom den høyere grunnleggende.
Størrelse : F-> Cl-> Br-> I-
Når man vurderer en rad i det periodiske bordet, jo større har atomet mindre elektrondensitet og det er mindre grunnleggende.
Resonans : RO-> RCO 2-
Molekyler med mer resonanskonstruksjoner er mindre grunnleggende, siden den mindre elektrontilgjengelighet enn en lokalisert negativ ladning.
Image Courtesy:
1. "WOA05 GLODAP pd ALK AYool" av Plumbago - eget arbeid. [CC BY-SA 3. 0] via Commons
2. "Thomas Martin Lowry2" av Anonym - Dødsfall av Faraday Soc. (1936). [Offentlig domene] via Commons




