Forskjell mellom SN1 og SN2-reaksjoner | SN1 og SN2 Reaksjoner
Nøkkel Forskjell - SN1 vs SN2 Reaksjoner
SN1- og SN2-reaksjonene er nukleofile substitusjonsreaksjoner og oftest funnet i Organic Chemistry. De to symbolene SN1 og SN2 refererer til to reaksjonsmekanismer. Symbolet SN står for "nukleofil substitusjon". Selv om både SN1 og SN2 er i samme kategori, har de mange forskjeller, inkludert reaksjonsmekanismen, nukleofiler og løsningsmidler deltok i reaksjonen, og faktorene som påvirker hastighetsbestemmende trinn. nøkkelforskjellen mellom SN1 og SN2-reaksjonene er at SN 1 reaksjonene har flere trinn mens SN 2 reaksjoner har bare ett trinn.
Hva er SN1-reaksjoner?
I SN1-reaksjoner indikerer 1 at hastighetsbestemmelsestrinnet er unimolekylært. Reaksjonen har således en førstegangsavhengighet av elektrofil og null rekkefølge av nukleofil. En karboksidering er dannet som et mellomprodukt i denne reaksjonen, og denne type reaksjoner forekommer ofte i sekundære og tertiære alkoholer. SN1-reaksjoner har tre trinn.
- Dannelse av karbokatalysasjonen ved å fjerne avgangsgruppen.

- Reaksjonen mellom karbokosisjonen og nukleofilen (Nukleofil angrep).

- Dette skjer bare når nukleofilen er en nøytral forbindelse (et løsningsmiddel).
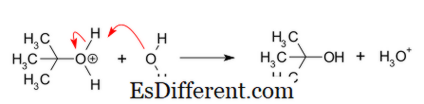
Hva er SN2-reaksjoner?
I SN2-reaksjoner brytes en binding, og en binding dannes samtidig. Med andre ord involverer dette forskyvningen av den forlatende gruppen med en nukleofil. Denne reaksjonen skjer veldig bra i metyl- og primæralkylhalogenider, mens det er svært sakte i tertiære alkylhalogenider siden baksideangrepene er blokkert av store grupper.
Den generelle mekanismen for SN2-reaksjoner kan beskrives som følger.
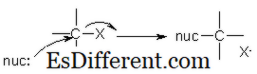
Hva er forskjellen mellom SN1 og SN2 Reaksjoner?
Kjennetegn ved SN1 og SN2 Reaksjoner:
Mekanisme:
SN1 Reaksjoner: SN 1 reaksjonene har flere trinn; det begynner med fjerning av avgangsgruppen, noe som resulterer i en karbonokasjon og deretter angrepet av nukleofilen.
SN2 Reaksjoner: SN 2 reaksjoner er enkelttrinnsreaksjoner hvor både nukleofil og substrat er involvert i hastighetsbestemmende trinn. Derfor vil konsentrasjonen av substratet og den for nukleofilen påvirke hastighetsbestemmelsestrinnet.
Reaksjonsbarrierer:
SN1 Reaksjoner: Det første trinnet med SN1-reaksjoner er å fjerne avgangsgruppen for å gi en karboklassering. Reaksjonshastigheten er proporsjonal med karbonoksidets stabilitet.Derfor er dannelsen av karbokatalysasjonen den største barrieren i SN1-reaksjoner. Stabiliteten av karbokokasjonen øker med antall substituenter og resonansen. Tertiære karbokasjoner er de mest stabile og primære karbokseringer er minst stabile (tertiær> sekundær> primær).
SN2 Reaksjoner: Sterisk hindring er barrieren i SN 2 reaksjoner siden den går gjennom et baksiden angrep. Dette skjer bare hvis de tomme orbitaler er tilgjengelige. Når flere grupper er festet til avgangsgruppen, bremser den reaksjonen. Så den raskeste reaksjonen oppstår i dannelsen av primære karbokasjoner, mens den langsommere er i tertiære karbokasjoner (primær-raskeste> sekundær> tertiær-sløyfe).
Nucleophile:
SN1 Reaksjoner: SN 1 reaksjoner krever svake nukleofiler; de er nøytrale løsningsmidler som CH 3 OH, H 2 O og CH 3 CH 2 OH. SN2 Reaksjoner: SN 2
reaksjoner krever sterke nukleofiler. Med andre ord er de negativt ladede nukleofiler slik som CH 3 O - , CN - , RS - , N 3 - og HO - . Løsemiddel: SN1 Reaksjoner: SN1-reaksjoner er favorisert av polare protiske løsningsmidler. Eksempler er vann, alkoholer og karboksylsyrer. De kan også fungere som nukleofiler for reaksjonen.
SN2 Reaksjoner:
SN2-reaksjoner går godt i polære aprotiske løsningsmidler som aceton, DMSO og acetonitril. Definisjoner:
Nucleophile : en kjemisk art som donerer et elektronpar til en elektrofil for å danne en kjemisk binding i forhold til en reaksjon.
Elektrofil
: et reagens tiltrukket av elektroner, de er positivt ladede eller nøytrale arter som har ledige orbitaler som tiltrekkes et elektronrikt sentrum. Referanser: Master Organisk Kjemi - Sammenligning av Organisk Kemi Portal for SN1 og SN2 Reaksjoner - Nukleofil Substitusjon (S
N 1S
N 2)


