Forskjell mellom reagens og reagens | Reaktant vs Reagens
Nøkkelforskjell - Reaktant vs Reagens
De to termene reaktant og reagens brukes i både organiske og uorganiske kjemiske reaksjoner. Selv om de to begrepene har lignende betydninger, er deres rolle i en bestemt reaksjon forskjellig fra en annen. nøkkelforskjellen mellom reaktant og reagens er at reaktanter er forbindelsene som forbrukes og er direkte involvert i reaksjonen mens reagenser brukes til å måle omfanget av en kjemisk reaksjon eller å observere reaksjonen .
Hva er et reagens?
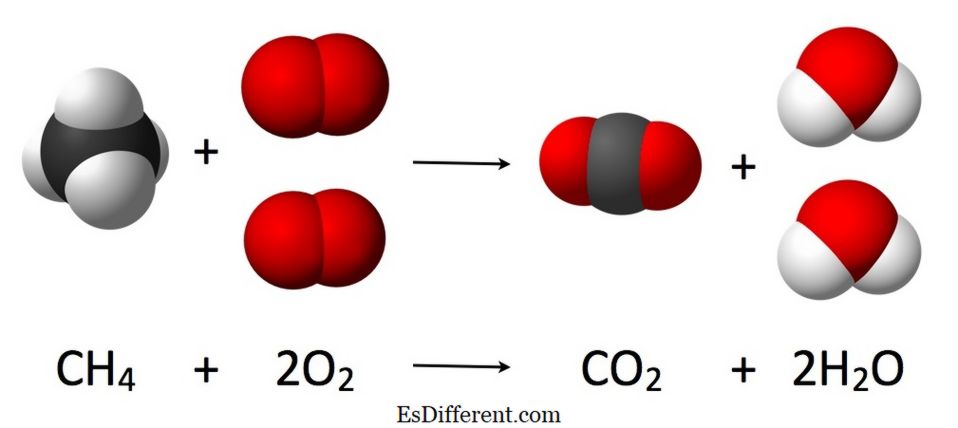
En reaktant er et stoff som er direkte involvert i en kjemisk reaksjon. Den initierer den kjemiske reaksjonen og forbrukes etter reaksjonen. Spesielt er det to eller flere reaktanter i en kjemisk reaksjon. Selv om løsningsmidler er involvert i en kjemisk reaksjon, anses de ikke som reaktanter. På samme måte forbrukes ikke katalysatorer etter den kjemiske reaksjonen; derfor betraktes de ikke som reaktanter.

Hva er et reagens?
Et reagens i en kjemisk reaksjon letter den kjemiske reaksjonen å forekomme, eller den brukes til å detektere, måle eller undersøke reaksjonsgraden uten å bli konsumert ved reaksjonens slutt. Det kan være en enkelt forbindelse eller en blanding av kjemiske forbindelser. Rollen og typen av reagenset er svært spesifikke for en bestemt reaksjon. Ulike reagenser brukes til forskjellige reaksjoner.
Eksempler på vanlige reagenser og deres funksjoner:
Collins reagens: For å selektivt oksidere primære alkoholer til aldehydet.
Fentons reagens: For å ødelegge organiske forbindelser som er forurensende stoffer.
Grignard Reagent: For å syntetisere organiske forbindelser med lang kjede som bruker alkyl / arylhalogenider.
Nesslers reagens: For å identifisere tilstedeværelsen av ammoniakk.
Benedict's Reagent: For å oppdage tilstedeværelsen av reduserende sukker (r). Andre reduserende stoffer gir også en positiv reaksjon.
Fehling's Reagent: For å skille mellom vannoppløselige karbohydrat- og ketonfunksjonelle grupper.
Millons reagens: For å identifisere tilstedeværelsen av oppløselige proteiner.
Tollen's Reagent: For å identifisere tilstedeværelsen av aldehyd- eller alfa-hydroksylketonfunksjonelle grupper.
Disse kjemiske reagensene kan grupperes i to kategorier; organiske kjemiske reagenser og uorganiske kjemiske reagenser.
- diff Artikkel Midt før tabell ->| Organiske reagenser | Uorganiske reagenser |
| Collins reagens | Nesslers reagens |
| Fentons reagens | Benedict's reagens |
| Grignard reagens | Fehlings reagens |
| Millons reagens | |
| Tollen's reagens |

Collins reagens
Hva er forskjellen mellom Reaktant og Reagens?
Definisjon:
Reagenser er stoffer som starter en kjemisk reaksjon og blir konsumert i prosessen.
Reagenser er stoffer som letter en kjemisk reaksjon og har spesifikke funksjoner.
Forbruk i kjemisk reaksjon:
Reaktanter forbrukes i kjemisk reaksjon; de blir produkter etter den kjemiske reaksjonen.
Reagenser er ikke nødvendigvis konsumert i en kjemisk reaksjon. De er vant til å oppdage, undersøke eller observere omfanget av en kjemisk reaksjon eller å identifisere visse funksjonelle grupper.
Antall forbindelser:
A reaktant er en enkelt forbindelse.
A reagens kan være en enkelt kjemisk forbindelse eller en blanding av flere kjemiske forbindelser.
| Reagens | Sammensetning |
| Tollen's reagens | En løsning av sølvnitrat (AgNO 3 ) og ammoniakk (NH 3 ) |
| Fehlings løsning Like mengder Fehlings A og Fehling's B-løsninger. | Fehlings
A er en blåfarget vandig løsning av kobber (II) sulfat (CuSO 4 ) Fehlings B er en klar og fargeløs løsning av vandig kaliumnatrium tartrat og et sterkt alkali (vanligvis natriumhydroksyd) Collins reagens |
| Et kompleks av krom (VI) oksid (CrO | 3 ) med pyridin i diklormetan (CH 2
Cl 2 ) Grignard reagens Produkt av reaksjonen av alkyl eller arylhalogenid med magnesiummetall (R-Mg-X) Nødvendighet i kjemiske reaksjoner: |
| Reaktanter | er involvert i alle kjemiske reaksjoner; Det er en nødvendig komponent i en kjemisk reaksjon. |
En reaksjon kan oppstå selv uten et kjemisk
reagens . Med andre ord, ikke alle kjemiske reaksjoner nødvendiggjorde nødvendigvis et kjemisk reagens.
Image Courtesy: 1. "Forbrenningsreaksjon av metan" av JyntoRobert A. RohdeJacek FHJynto [CC BY-SA 3. 0] via Commons 2. Collins reagent Ved Mephisto spa (eget arbeid) [Public domain], via Wikimedia Commons





