Forskjell mellom oktet og duplet | Octet vs Duplet
Nøkkelforskjell - Octet vs Duplet
Det finnes kjemisk aktive og inaktive atomer eller forbindelser som er til stede i naturen. Denne egenskapen er hovedsakelig avhengig av antall elektroner som er tilstede i atomens ytre skall. Atomer som har ufullstendige skall kan bli aktive for å fullføre deres elektronkonfigurasjon for å bli stabil. Atomer som er inaktive har en komplett elektronkonfigurasjon; Derfor reagerer disse atomer ikke med noe annet atom, med mindre de er under spesielle forhold. Noble gasser er alltid inaktive i naturen. Derfor er de kjent som inerte gasser. Inerte gasser er i den åttende kolonnen i periodisk tabell. Andre elementer i samme periode (rad) har en tendens til å oppnå elektronkonfigurasjonen av den inerte gass i slutten av den perioden, som er den mest stabile formen i naturen. Aktive atomer har en tendens til å fullføre antall elektroner i henhold til oktettregel eller dupliseringsregel . Hovedforskjellen mellom oktet og duplisert er at oktet er et atom eller en ion som har maksimalt åtte elektroner i ytterste skallet mens duplet er et atom som har maksimalt to elektroner i ytterste skall.
INNHOLD
en. Oversikt og nøkkelforskjell
2. Hva er en Octet
3. Hva er en Duplet
4. Side ved side-sammenligning - Octet vs Duplet
5. Sammendrag
Hva er en Octet?
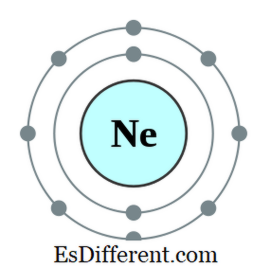
En oktett er et atom eller en ion som har åtte elektroner i det ytterste skallet til det atomet. Alle edle gasser unntatt helium har åtte elektroner og er inerte i naturen. Elektronkonfigurasjonen av en edel gass vil alltid ende som følger.
N22 np 6 Eksempelvis er elektronkonfigurasjonen av Neon 1s
2 2s 2 2p 6 . Neon er en inert gass. Andre elementer som har syv, seks osv. Elektroner i ytterste bane har en tendens til å adlyde oktetregelen ved å skaffe elektroner fra utsiden; noen andre elementer som har en, to, etc., elektroner har en tendens til å miste elektroner og oppnå elektronkonfigurasjonen av nærmeste inerte gass. Men andre elementer i midten av det periodiske bordet danner nye bindinger med elementer som har overskytende elektroner for å dele disse elektronene og bli en oktett.
Hva er en Duplet?
Hydrogenatom og heliumatom er de minste elementene i naturen og har bare en omkrets rundt kjernen. Denne orbitalen kalles 1s omløp. Denne orbitalen kan inneholde maksimalt to elektroner. Hydrogenatom har en elektron og helium har to elektroner. Derfor kalles helium en duplisering.Helium har det maksimale antall elektroner det kan ha; dermed er det et stabilt element i naturen. Derfor er Helium også en inert gass. Men hydrogen har bare en elektron, og det eneste orbitalet den har er ufullstendig. Således er hydrogenatom alene meget reaktivt og det har en tendens til å danne en kovalent binding med et annet hydrogenatom ved å dele de eneste elektronene de har. Da blir disse hydrogenatomene dupliserte, da de nå har to elektroner i deres ytterste orbitaler. Men litium kan også oppføre seg som en duplisering ved å fjerne elektronen fra sin ytre omgang. Lithiums elektronkonfigurasjon er 1s
2 2s 1 . Ved å fjerne 2s 1 elektronen, kan det bli en duplisering. I så fall er He, H - og Li + duplikater som kan eksistere som stabile duplikater. Alle dupliseringer har elektronkonfigurasjon som følger.
ns
2 Figur 02: Helium, en duplisering

Hva er forskjellen mellom Octet og Duplet?
- diff Artikkel Mellom før Tabell ->
Octet vs Duplet
Octet har åtte elektroner i ytterste skall. |
|
| Duplet har to elektroner i ytterste skall. | Common Electron Configuration |
| Octet har ns | |
| 2 np 6 type elektronkonfigurasjon på slutten. Duplet har ns | 2 type konfigurasjon på slutten. Antall orbitaler |
| Oktet kan ha minst to orbitaler. | |
| En duplikat har bare en orbital. | Type orbitaler |
| En oktett kan ha alle typer orbitaler som s, p, d, f, etc. | |
| Duplet har bare s orbitalt. | Sammendrag - Octet vs Duplet |
Alle elementer har en tendens til å bli stabil. Men med ufullstendige elektronkonfigurasjoner kan atomer ikke være stabile; Dermed blir de svært reaktive for å fylle skallene med elektroner ved å vinne, miste eller dele elektroner. Atomer eller molekyler som adlyder oktett- eller duplettregelen er stabile. Hovedforskjellen mellom oktet og duplikat er at oktetten har åtte elektroner i sin ytre omgang mens duplikat har to elektroner i sin orbitale.
Referanser:
1. Nema, P., 2011. Topperlearning. [Online] Tilgjengelig på: // www. topperlearning. com / forums / home-work-help-19 / what-is-octet-duplet-valency-and-ions-chemistry-structure-of-the-atom-46317 / svar [Tilgang 29 05 2017].
2. Chang, R., 2010. Kjemi. 10. utg. New York: McGraw-Hill.
3. Anon., 2015. Grade stacker. [Online] Tilgjengelig på: // gradestack. com / NTSE-Complete-Course / Kjemisk-Bonding / Chemical-Activity-of-An / 19176-3853-37737-study-wtw [Tilgang 29 05 2017].
Image Courtesy:
1. "Electron shell 002 Helium - no label" Av Pumbaa (originalarbeid av Greg Robson) - Elektronisk skalldiagrammer (tilsvarende merket versjon) (CC BY-SA 2. 0 uk) via Commons Wikimedia
2. "Electron shell 010 Neon" Av Pumbaa (originalt arbeid av Greg Robson) (CC BY-SA 2. 0 uk) via Commons Wikimedia




