Forskjell mellom metan og etan | Metan vs Etan
Hovedforskjell - Metan vs Ethane
Metan og etan er de minste medlemmene av alkanfamilien. De molekylære formlene av disse to organiske forbindelsene er henholdsvis CH 4 og C 2 H 6 . nøkkelforskjellen mellom metan og etan er deres kjemiske struktur ; Et etanmolekyl kan betraktes som to metylgrupper som er tilsluttet som dimer av metylgrupper. De andre kjemiske og fysiske forskjellene oppstår hovedsakelig på grunn av denne strukturelle forskjellen.
Hva er metan?Metan er det minste medlemmet av alkanfamilien med kjemisk formel CH
4 (fire hydrogenatomer er bundet til ett karbonatom). Det anses å være den viktigste komponenten av naturgass. Metan er en fargeløs, luktfri og smakløs gass; også kjent som karban, myrgas, naturgass, karbontetrahydrid, og hydrogenkarbid . Det kan lett antennes, og dampen er lettere enn luften.
3 - med vann i atmosfæren. Hva er etan?
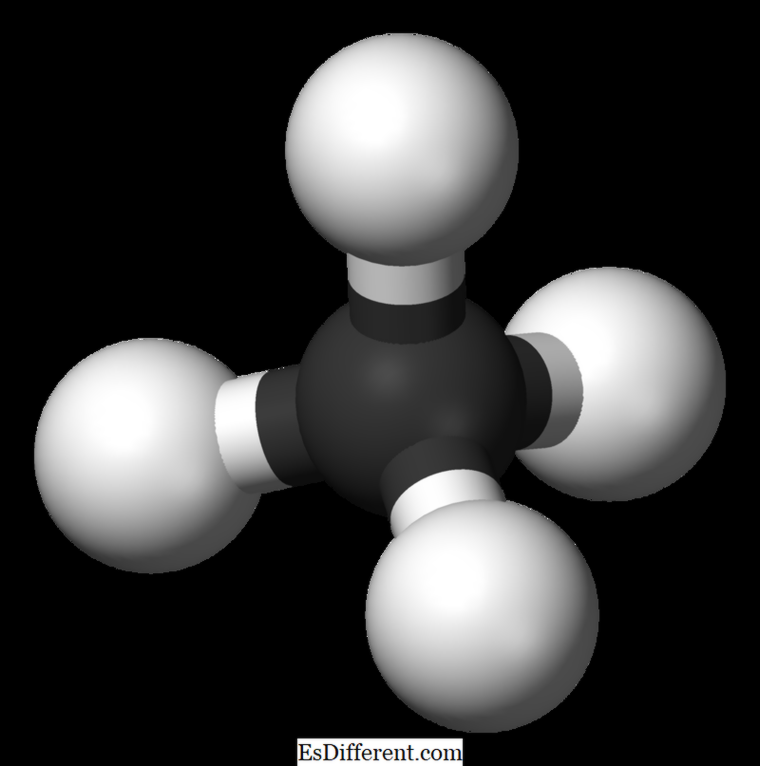
Etan er en fargeløs, luktfri gassformig forbindelse ved standard temperatur og trykk. Dens molekylære formel og molekylvekt er henholdsvis C
2 H 6 og 30 07 g · mol -1 . Det er isolert fra naturgass, som et biprodukt fra petroleumsraffinering. Etan er svært viktig i etylenproduksjon.

Kjennetegn av metan og etan
Struktur:
Metan:
Den molekylære formel av metan er CH 4, og det er et eksempel av et tetraederalt molekyl med fire ekvivalente CH-bindinger (sigma-bindinger). Forbindelsesvinkel mellom H-C-H-atomer er 109. 5 0 og alle C-H-bindingene er ekvivalente, og det er lik 108. 70 pm. Etan: Den molekylære formel av etan er

C 2 H 6, og det er et mettet hydrokarbon siden det ikke inneholder flere obligasjoner. Kjemisk egenskaper: Metan: Stabilitet: Metan er et kjemisk svært stabilt molekyl som ikke reagerer med KMnO

4
, K
2 Cr < 2 O 7 , H 2 SO 4 eller HNO 3 under normale forhold. Forbrenning: Ved tilstedeværelse av overflødig luft eller oksygen brenner metan med en lyseblå ikke-lysende flammeproduserende karbondioksid og vann.Det er en svært eksoterm reaksjon; Derfor brukes den som et utmerket drivstoff. I nærvær av utilstrekkelig luft eller oksygen, brenner den delvis til karbonmonoksid (CO) -gass. Substitusjonsreaksjoner: Metan viser substitusjonsreaksjoner med halogener. I disse reaksjonene erstattes ett eller flere hydrogenatomer med et like antall halogenatomer og det kalles "halogenering". "Det reagerer med klor (Cl) og brom (Br) i nærvær av sollys. Reaksjon med damp:
Når en blanding av metan og damp føres gjennom et oppvarmet (1000 K) nikkel, som er støttet på aluminiumoksydoverflaten, kan det produsere hydrogen. Pyrolyse:
Når metan blir oppvarmet til ca. 1300 K, blir det nedbrytet til karbon svart og hydrogen. Etan:
Reaksjoner: Etangas (CH 3
CH 3 ) reagerer med bromndamp i nærvær av lys for å danne brometan, (CH 3
CH
2 Br) og hydrogenbromid (HBr). Det er en substitusjonsreaksjon; et hydrogenatom i etan er substituert med bromatom. CH 3 CH 3 + Br 2 à CH 3
CH 2 Br + HBr Forbrenning: Den komplette forbrenningen av etan produserer 1559. 7 kJ / mol (51,9 kJ / g) av varme, karbondioksid og vann. 2 2 H 6 + 7 O 2
→ 4 CO
2 + 6 H 2 O + 3120 kJ Det kan også forekomme uten overskudd av oksygen, og produserer en blanding av amorft karbon og karbonmonoksid. 2 C 2 H 6 + 3 O 2 → 4 C + 6 H
2
O + energi 2 C 2 H 6 + 5 O 2 → 4 CO + 6 H 2
O + energi 2 C 2 H 6 + 4 O 2 → 2 C + 2 CO + 6 H 2
O + energi etc. Definisjoner: Substitusjonsreaksjoner: Substitusjonsreaksjon er en kjemisk reaksjon som involverer forskyvning av en funksjonell gruppe i en kjemisk forbindelse og erstattet det ved en annen funksjonell gruppe. Bruk: Metan: Metan brukes i mange industrielle kjemiske prosesser (som drivstoff, naturgass, flytende naturgass) og transporteres som kjølt væske. Etan: Etan brukes som drivstoff for motorer og som kjølemiddel for et ekstremt lavtemperatursystem. Den leveres i stålbeholdere som en flytende gass under eget damptrykk. Referanser: "Ethane".
Wikipedia
. N. p., 2016. Web. 7. juni 2016. Khanna, Bhishm. "Hva er de kjemiske egenskapene til metan? ”. Preservearticles. no. N. p., 2016. Web. 7. juni 2016. "Metan | CH4 - Pubchem ".
pubchem. NCBI. NLM. NIH. gov
. N. p., 2016. Web. 7. juni 2016. "Metan". Wikipedia
. N. p., 2016. Web. 7 juni 2016. Image Courtesy: "Ball-and-stick modell av metanmolekyl" av (Public Domain) via Commons Wikimedia "Ball-and-stick-modell av etanmolekyl" y Ben Mills - Egentlig arbeid (Public Domain) via Commons Wikimedia "Metan" Av Jynto - Eget arbeid, basert på fil: metan-CRC-MW-dimensjoner-2D.png, (Public Domain) via Commons Wikimedia "Ethane" (Public Domain) via Commons Wikimedia


