Forskjell mellom IgM og IgG | IgM vs IgG
Nøkkelforskjellen - IgM vs IgG
Immunoglobulin M (IgM) og Immunoglobulin G (IgG) er antistoffer eller immunglobulin (Ig) proteiner produsert av immunsystemet for å bekjempe infeksjonene og ødelegge antigener. IgM er et pentamerisk molekyl som opptrer i tidlig stadium av infeksjon, og den har ti antigenbindingssteder. IgG er et monomert molekyl som fremkommer ved senere infeksjon og har to antigenbindingssteder . Dette er nøkkelforskjellen mellom IgM og IgG. Følgende informasjon om IgM og IgG vil hjelpe deg å forstå den strukturelle og funksjonelle forskjellen mellom IgM og IgG.
INNHOLD
en. Oversikt og nøkkelforskjell
2. Hva er et immunoglobulin (Ig)
3. Hva er IgM
4. Hva er IgG
5. Side ved side Sammenligning - IgM vs IgG
6. Sammendrag
Hva er et immunoglobulin (Ig)?
Immunoglobulin (Ig), også referert som et antistoff, er en type protein produsert av hvite blodlegemer i immunsystemet for å reagere mot infeksjoner forårsaket av bakterier, virus, sopp, protozoan, toksin, etc. Ig er et Y-formet, stort glykoproteinmolekyl bestående av fire polypeptider kjent som tunge og lette kjeder som vist i figur 01. Det er to hovedområder av polypeptidkjeden: variabel og konstant. Aminosyresekvenser i den variable region av polypeptidene varierer i stor grad mellom immunoglobulinisotypene. Det er fem hovedisotyper av immunglobuliner: IgA, IgD, IgE, IgG og IgM. Isotyper er kategorisert i henhold til deres strukturelle forskjeller. De har forskjellige funksjoner og antigenresponser.
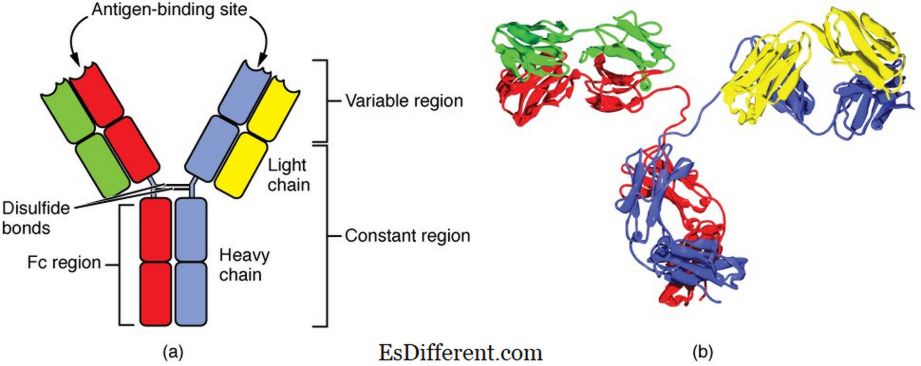
Figur_1: Fire kjede strukturer av et genetisk antistoff
Hva er IgM?
IgM er den første typen antistoff laget i kroppen som det første svaret på en infeksjon av immunsystemet. Det er det største antistoffet i kroppen og mindre rikelig (5 til 10%) enn de andre antistoffene. IgMer produseres av plasmaceller og er tilstede i blod og lymfevæsker. IgM eksisterer som en pentamer bestående av identiske tunge og lette kjeder som vist i figur 02. Det er ti antigenbindingssteder for IgM. På grunn av konformasjonelle begrensninger av IgM er imidlertid kun fem steder tilgjengelige for antigenbinding. IgM er ansvarlig for tidlig ødeleggelse av antigenet og kontroll av infeksjon.
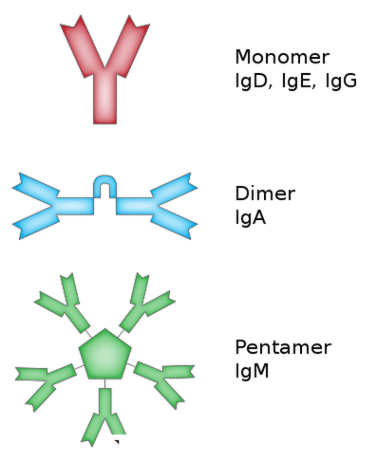
Figur 2: Struktur av IgG og IgM
Hva er IgG?
IgG er en annen type antistoff produsert av hvite blodlegemer og finnes i alle kroppsvæsker. Det er det mest omfattende antistoffet som finnes i immunsystemet (80%) og det minste antistoffet.IgG er produsert i de senere stadiene av infeksjonen og forblir i kroppen for å bekjempe gjentatte infeksjoner. IgG-antistoffer er i stand til å krysse moderen til en gravid mor og beskytte fosteret mot infeksjoner på grunn av sin lille størrelse. IgG'er eksisterer som monomerer med to antigenbindingssteder i hvert antistoff som vist i figur 02.
Hva er forskjellen mellom IgM og IgG?
- diff Artikkel Mellom før Tabell ->
IgM vs IgG |
|
| IgM er et pentamerisk molekyl som vises i tidlig stadium av infeksjon. | IgG er et monomert molekyl som fremkommer ved senere infeksjonsfase. |
| Første utseende i en organisme | |
| Første antistoff produseres av de jomfruelige plasmacellene i fosteret. | Dette er ikke det første antistoffet som produseres av fostrets frie plasmaceller. |
| Størrelse og overflod | |
| IgM er det største antistoffet, men det minste rikelig antistoff i kroppen. | IgG er det minste og svært rikelig antistoff i kroppen. |
| Struktur | |
| IgM er et pentameter. | IgG er en monomer. |
| Tilstedeværelse | |
| Det finnes i blodet og lymfevæsken. | Det finnes i alle kroppsvæsker. |
| Antigenbindingssteder | |
| Den har 10 eller 12 bindingssteder for antigener. | Den har to bindingssteder for antigener. |
| Placenta | |
| Siden det er et større antistoff, kan det ikke krysse moderkaken. | Det er den eneste antistoff typen som kan krysse moderkaken og bygge fostrets immunitet. |
| Tilstedeværelse i kolostrum | |
| IgM er fraværende i kolostrummet. | IgG er tilstede i kolostrummet. |
| Typer | |
| Det er bare én type IgMer. | Det finnes fire typer IgGer. |
| Immunologi Test | |
| IgM indikerer gjeldende infeksjon. | Immunologisk test indikerer nylig eller tidligere forekomst av infeksjonen. |
Sammendrag - IgM vs IgG
Både (IgM) og (IgG) er typer immunoglobulinproteiner som finnes i immunsystemet for å bekjempe infeksjoner. De er antistoffer syntetisert av plasmacellene for å binde med spesifikke fremmede antigener, som kommer inn i kroppen etterfulgt av infeksjoner. Når disse antistoffene binder til spesifikke antigener, kan immunsystemet identifisere infeksjonscellene og ødelegge patogenene.
IgM-antistoffer vises så snart kroppen er eksponert for infeksjonen mens IgG-antistoffer opptrer etter få dager etter infeksjonen når IgM-antistoffene er forsvunnet fra kroppen. Dette er nøkkelforskjellen mellom IgM og IgG.
Referanse:
1. "IMMUNOGLOBULINER - STRUKTUR OG FUNKSJON. "IMMUNOGLOBULINER - STRUKTUR OG FUNKSJON. N. p., n. d. Web. 8. februar 2017
2. "Lærebok for mikrobiologi og immunologi. "Google Bøker. N. p., n. d. Web. 08 Feb. 2017
Image Courtesy:
1. "Mono-und-Polymere" Av Martin Brändli (brandlee86) - Eget arbeid (CC BY-SA 2. 5) via Commons Wikimedia
2. "2220 Four Chain Structure of a Generic Antibody-IgG2 Structures" ved OpenStax College - Anatomy & Physiology, Connexions nettsted. 19. juni 2013. (CC BY 3. 0)




