Forskjell mellom enzym og koenzym | Enzym vs koenzym
Nøkkelforskjell - Enzym vs Koenzym
Kjemiske reaksjoner konverterer en eller flere substrater til produkter. Disse reaksjonene blir katalysert av spesielle proteiner som kalles enzymer. Enzymer fungerer som katalysator for de fleste reaksjoner uten å bli konsumert. Enzymer er laget av aminosyrer og har unike aminosyresekvenser sammensatt av 20 forskjellige aminosyrer. Enzymer støttes av små ikke-proteiniske organiske molekyler kalt cofactors. Koenzymene er en type kofaktorer som hjelper enzymer til å utføre katalyse. Hovedforskjellen mellom enzym og koenzym er at enzym er et protein som katalyserer de biokjemiske reaksjonene mens koenzym er et ikke-proteinorganisk molekyl som hjelper enzymer til å aktivere og katalysere de kjemiske reaksjonene. Enzymer er makromolekyler mens koenzymer er små molekyler.
INNHOLD
en. Oversikt og nøkkelforskjell
2. Hva er et enzym
3. Hva er et koenzym
4. Side ved side-sammenligning - Enzym vs Koenzym
5. Sammendrag
Hva er et enzym?
Enzymer er biologiske katalysatorer av levende celler. De er proteiner som består av hundrevis til millioner av aminosyrer festet sammen som perler på en streng. Hvert enzym har en unik aminosyresekvens, og den bestemmes av et bestemt gen. Enzymer akselererer nesten alle de biokjemiske reaksjonene i levende organismer. Enzymer påvirker bare reaksjonshastigheten, og deres tilstedeværelse er essensielt for å initiere den kjemiske omdannelse fordi aktiveringsenergi av reaksjonen senkes av enzymer. Enzymer endrer reaksjonshastigheten uten å bli konsumert eller uten å endre den kjemiske strukturen. Det samme enzymet kan katalysere omdannelsen av flere og flere substrater til produkter ved å vise evnen til å katalysere den samme reaksjonen igjen og igjen.
Enzymer er svært spesifikke. Et bestemt enzym binder med et spesifikt substrat og katalyserer en bestemt reaksjon. Specificiteten av enzymet er forårsaket av formen av enzymet. Hvert enzym har et aktivt sted med en bestemt form og funksjonelle grupper for spesifikk binding. Bare det spesifikke underlaget vil matche formen på det aktive stedet og binde seg til det. Specificiteten av enzym-substratbindingen kan forklares ved to hypoteser som heter lås- og nøkkelhypotesen og indusert pasienthypotesen. Lås- og nøkkelhypotesen angir at kampen mellom enzym og substrat er spesifikk som lås og nøkkel. Induced fit hypothesis forteller at formen på det aktive stedet kan endres for å passe formen på det spesifikke substratet som ligner på hansker som passer til hånden.
Enzymatiske reaksjoner påvirkes av flere faktorer som pH, temperatur osv. Hvert enzym har en optimal temperaturverdi og pH-verdi for å fungere effektivt. Enzymer interagerer også med ikke-proteinkofaktorer som protese grupper, koenzymer, aktivatorer etc. for å katalysere biokjemiske reaksjoner. Enzymer kan ødelegges ved høy temperatur eller med høy surhet eller alkalitet fordi de er proteiner.

Figur 01: Induced fit modell av enzymaktivitet.
Hva er et koenzym?
Kjemiske reaksjoner støttes av ikke-proteinmolekyler kalt kofaktorer. Kofaktorer hjelper enzymer til å katalysere kjemiske reaksjoner. Det finnes forskjellige typer kofaktorer, og koenzymer er en type blant dem. Koenzym er et organisk molekyl som kombinerer med et enzym-substratkompleks og hjelper katalysaseprosessen til reaksjonen. De er også kjent som hjelpemolekyler . De består av vitaminer eller avledet av vitaminer. Derfor bør dietter inneholde vitaminer som gir essensielle koenzymer for de biokjemiske reaksjonene.
Koenzym kan binde seg med enzymets aktive sted. De binder løst med enzymet og hjelper den kjemiske reaksjonen ved å gi funksjonelle grupper som trengs for reaksjonen eller ved å endre enzymkonstruksjonens konformasjon. Derfor blir bindingen av substratet lett, og reaksjonen går mot produktene. Noen koenzymer virker som sekundære substrater og blir kjemisk forandret på slutten av reaksjonen, i motsetning til enzymer.
Koenzym kan ikke katalysere en kjemisk reaksjon uten et enzym. De hjelper enzymer til å bli aktive og utføre sine funksjoner. Når koenzymet binder med apoenzymet, blir enzymet en aktiv form av enzymet kalt holoenzym og initierer reaksjonen.
Eksempler på koenzymer er adenosintrifosfat (ATP), Nikotinamid-adenin-dinukleotid (NAD), Flavin-adenin-dinukleotid (FAD), Koenzym A, Vitaminer B1, B2 og B6, etc.
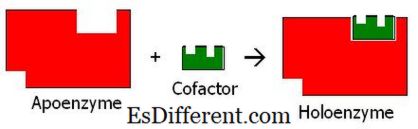
Figur 02: Cofaktorbinding med en apoenzyme
Hva er forskjellen mellom enzym og koenzym?
- diff Artikkel Midt før tabell ->
Enzym vs koenzym |
|
| Enzymer er biologiske katalysatorer som akselererer kjemiske reaksjoner. | Koenzym er organiske molekyler som hjelper enzymer til å katalysere de kjemiske reaksjonene. |
| Molekylær type | |
| Alle enzymer er proteiner. | Koenzym er ikke-proteiner. |
| Endring på grunn av Reaksjoner | |
| Enzymer endres ikke på grunn av kjemisk reaksjon. | Koenzymene blir kjemisk forandret som et resultat av reaksjonen. |
| Specificitet | |
| Enzymer er spesifikke. | Koenzymer er ikke spesifikke. |
| Størrelse | |
| Enzymer er større molekyler. | Koenzym er mindre molekyler. |
| Eksempler | |
| Amylase, proteinase og kinase er eksempler på enzymer. | NAD, ATP, koenzym A og FAD er eksempler på koenzymer. |
Sammendrag - Enzym vs Koenzym
Enzymer katalyserer kjemiske reaksjoner. Koenzymene hjelper enzymer til å katalysere reaksjonen ved å aktivere enzymer og gi funksjonelle grupper.Enzymer er proteiner sammensatt av aminosyrer. Koenzym er ikke proteiner. De er hovedsakelig avledet av vitaminer. Dette er forskjellene mellom enzymer og koenzymer.
Referanse:
1. “enzymer. "RSC. N. p., n. d. Web. 15. mai 2017..
2. "Strukturell biokjemi / enzym / koenzymer. "Structural Biochemistry / Enzyme / Coenzymes - Wikibooks, åpne bøker for en åpen verden. N. p., n. d. Web. 15. mai 2017..
Image Courtesy:
1. "Induced fit diagram" Av Laget av TimVickers, vektorisert av Fvasconcellos - Leveres av TimVickers (Public Domain) via Commons Wikimedia
2. "Enzymer" Av Moniquepena - Eget arbeid (Public Domain) via Commons Wikimedia



