Forskjell mellom kombinasjons- og dekomponeringsreaksjon | Kombinasjon mot dekomponeringsreaksjon
Nøkkelforskjell - Kombinasjon mot dekomponeringsreaksjon
En kjemisk reaksjon er omdannelsen av en eller flere kjemiske forbindelser til en eller flere forskjellige produkter, endrer identiteten til en kjemisk forbindelse. Utgangsmaterialet til en kjemisk reaksjon kalles reaktanten og den resulterende forbindelse kalles produktet. Fordeling av forbindelser eller kombinasjon av forbindelser og dannelse av nye forbindelser vil oppstå under en kjemisk reaksjonsprosess siden bindingene mellom atomer av forbindelsen er brutt og opprettet på en annen måte. Kjemiske reaksjoner kan deles inn i flere brede kategorier. Redoksreaksjoner eller oksidasjonsreduksjonsreaksjoner er svært viktige blant dem. Oksidasjons- og reduksjonsreaksjonene kalles elektronoverføringsreaksjoner da elektronene av reaktanter overføres fra en forbindelse til den andre for å forårsake reaksjonen. I redoksreaksjoner oppstår to parallelle reaksjoner, som kalles halvreaksjoner, samtidig. Disse halvreaksjonene viser overføringen av elektroner. Ved å balansere disse halvreaksjonene kan man gjette den generelle reaksjonen som har skjedd på slutten. Kombinasjonsreaksjoner og dekomponeringsreaksjoner er to hovedtyper av redoksreaksjoner. Hovedforskjellen mellom kombinasjons- og dekomponeringsreaksjon er at kombinasjonsreaksjon innebærer en kombinasjon av reaktanter for å gi et enkelt produkt mens dekomponeringsreaksjon involverer nedbrytning av en enkelt forbindelse i to eller flere produkter.
INNHOLD
en. Oversikt og nøkkelforskjell
2. Hva er en kombinasjonsreaksjon
3. Hva er en dekomponeringsreaksjon
4. Side ved side-sammenligning - Kombinasjon mot dekomponeringsreaksjon
5. Sammendrag
Hva er en kombinasjonsreaksjon?
En kombinasjonsreaksjon, også kalt som syntesereaksjon , er en reaksjon der reaktantforbindelser kombineres for å danne en annen forbindelse som produktet. Med andre ord resulterer reaksjonen av enkle molekyler i et komplekst molekyl. Noen eller alle bindingene mellom atomer av den aktuelle forbindelse er brutt ned; Samtidig vil atomer kombinere for å danne den nye forbindelsen, som er produktet. I dekomponeringsreaksjoner virker den samme reaktant som utgangsmateriale for begge halvreaksjoner.I motsetning til dekomponeringsreaksjoner har de halve reaksjonene i kombinasjonsreaksjoner i utgangspunktet forskjellige reaktanter. Kombinasjonsreaksjon resulterer i et enkelt produkt. Følgende er et vanlig eksempel som kan gis som forbrenningsreaksjoner.
Eksempelvis når aluminium (Al) er plassert i flytende bromid (Br2 ), oppstår en kombinasjonsreaksjon og produserer aluminiumbromid (AlBr 3 ). Her økes oksidasjonsnummeret i Al og reduseres i Br. Derfor er det en redoksreaksjon og er en kombinasjonsreaksjon siden to reaktanter har reagert for å gi et bestemt produkt. Figur 01: Kombinasjonsreaksjon
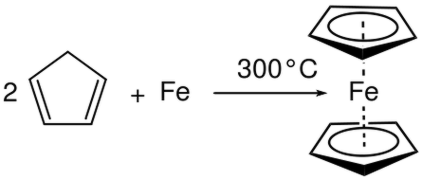
Dekomponeringsreaksjon er en annen viktig reaksjon i kategorien av redoksreaksjoner. Det er i utgangspunktet det motsatte av kombinasjonsreaksjon. En dekomponeringsreaksjon er en reaksjon hvor reaktantforbindelsen brytes ned i produkter. Her forekommer halvreaksjoner samtidig som oksidasjonsreaksjonen og reduksjonsreaksjonen. Men i motsetning til i kombinasjonsreaksjon er reaktanten for begge halvreaksjoner den samme i dekomponeringsreaksjoner. Nedbrytningsreaksjon resulterer i flere produkter.
Ved elektrolyse av vann, når likestrøm passerer gjennom vann, brytes vannmolekylene ned for å gi oksygen og hydrogengasser. Her økes oksidasjonsnummeret i oksygenatom og reduseres i hydrogenatom. Det er derfor en redoksreaksjon og en dekomponeringsreaksjon på grunn av nedbrytning av vannmolekyler i oksygen og hydrogengasser.
Figur 02: Kombinasjon mot dekomponering

Hva er forskjellen mellom kombinasjons- og dekomponeringsreaksjon?
- diff Artikkel Midt før tabell ->
Kombinasjon mot dekomponeringsreaksjon
To eller flere reaktantforbindelser er involvert i kombinasjonsreaksjoner. |
|
| En enkelt forbindelse er involvert i en dekomponeringsreaksjon. | Produkter |
| Kombinasjonsreaksjon resulterer i et enkelt produkt. | |
| Dekomponeringsreaksjoner resulterer i flere produkter. | Halvreaksjoner |
| I kombinasjonsreaksjoner har to halvreaksjoner to forskjellige startmolekyler. | |
| I dekomponeringsreaksjoner virker et enkelt molekyl som utgangsmateriale for begge halvreaksjoner. | Kjemiske bindinger |
| Kombinasjonsreaksjoner resulterer i binding av atomer for å produsere enkeltproduktet. | |
| Ved dekomponeringsreaksjoner brytes kjemiske bindinger ned for å danne to eller flere sluttprodukter. | Molekyler |
| Kombinasjonsreaksjoner fører til at enkle molekyler reagerer og produserer komplekse molekyler. | |
| Dekomponeringsreaksjoner fører til at komplekse molekyler brytes ned i enkle molekyler. | Sammendrag - Kombinasjon mot dekomponeringsreaksjon |
Redoksreaksjoner er veldig mye en del av verden rundt oss fordi de fleste av de viktigste kjemiske reaksjonene er redoksreaksjoner. Kombinasjonsreaksjoner og dekomponeringsreaksjoner er enkle reaksjoner som er motsatte av hverandre. Hovedforskjellen mellom kombinasjons- og dekomponeringsreaksjon er at kombinasjonsreaksjonen involverer kombinasjonen av to eller flere reaktantmolekyler for å resultere i et enkelt sluttprodukt mens dekomponeringsreaksjon involverer nedbrytning av et enkelt molekyl i to eller flere produkter.
Referanser:
1. Chang, R., 2010. kjemi. 10. utg. NewYork: McGraw-Hill.
2. Redox. (2009, 30. juli). Hentet 29. mai 2017, fra // svakinteraksjoner. wordpress. com / primere / redox /
3. Reaksjoner. (n. d.). Hentet 29. mai 2017, fra // www. ric. edu / fakultet / ptiskus / reaksjoner /
Image Courtesy:
1. "Miller Ferrocen Synthese" Av Bert. Kilanowski - eget arbeid (CC0) via Commons Wikimedia
2. "Kjemiske reaksjoner" Av Daniele Pugliesi - Eget arbeid (CC BY-SA 3. 0) via Commons Wikimedia [Cropped]



