Forskjell mellom acid-base titrering og redox titrering | Acid-Base Titrering vs Redox Titrering
Nøkkelforskjell - Syr-Base Titrering vs Redox Titrering
Generelt, Titreringer brukes til å bestemme konsentrasjonen av en ukjent løsning (analyt). De mest brukte to titrimetriske metoder er syre-base titreringer og redoks titreringer. nøkkelforskjellen mellom syre-base titreringer og redoks titreringer er karakteren av reaksjonen som skjer mellom titranten og analytten i titreringen. I syrebaserte titreringer finner en nøytraliseringsreaksjon sted og i redokstitreringer finner en redoksreaksjon (en oksidasjonsreaksjon og en reduksjonsreaksjon). Bruk av indikatorer er den mest brukte metoden for å bestemme reaksjonens endepunkt.
Hva er en acid-base titrering?
Ved syrebaserte titreringer brukes en syre (sure titreringer) eller en base (basiske titreringer) som titreringsmiddel. Eksempler på syrer anvendt i sure titreringer er H 2 SO 4 , HCI eller HNO 3. Mest anvendte basiske titranter er NaOH, K 2 CO 3 eller Na 2 CO 3. Syrebase titreringer kan klassifiseres som følger avhengig av styrken av syren og basen.
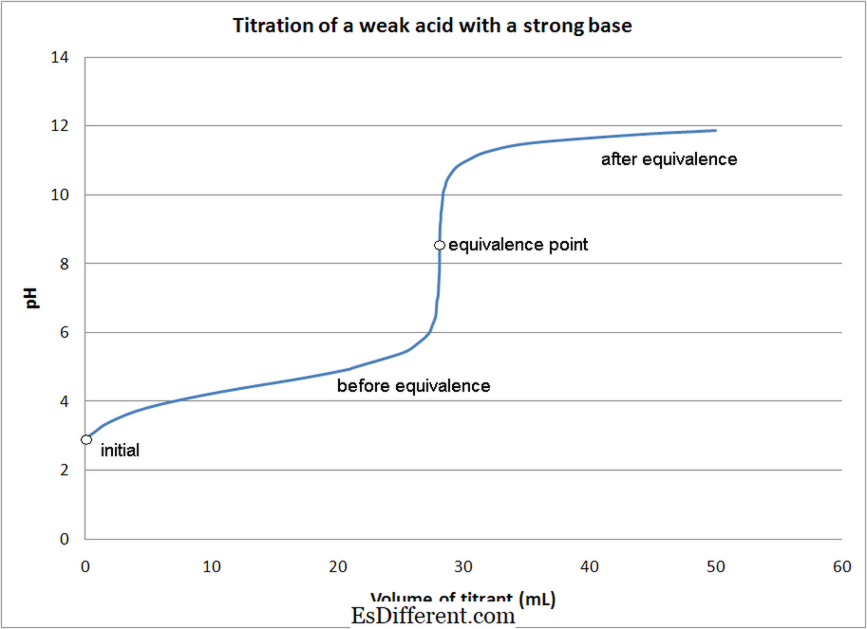
Sterk syre - sterke basetitreringer- Sterke syre-svake basetitreringer
- Svak syre - Sterke basetitreringer
- Svak syre - Svake basetitreringer
- I det meste av syren -baserte titreringer, indikatorer brukes til å bestemme slutpunktet for reaksjonen. Ulike indikatorer brukes, avhengig av typen av titrering som nevnt ovenfor.
En redoksitrering innebærer en redoksreaksjon. Redoksreaksjon har to reaksjoner; en oksidasjonsreaksjon og en reduksjonsreaksjon. Både oksidasjons- og reduksjonsprosesser finner sted samtidig hvor vi tillater å bestemme fullføringen av reaksjonen. Dette kalles også titreringens sluttpunkt. Dette kan bestemmes på flere måter; ved hjelp av indikatorelektroder, redoksindikatorer (indikatoren gir en annen farge ved oksydasjonsreduksjonsstatus), og ikke-redoksindikatorer (indikator gir en farge når en overskytende mengde titrer er tilsatt).
Hva er forskjellen mellom Acid-Base Titration og Redox Titration?

Reaksjonsart:
Syrebasertitrering:
En syrebasertitrering innebærer en nøytraliseringsreaksjon mellom analysen (løsningen med ukjent konsentrasjon) og den sure eller basiske titranten. Redoks Titrering:
En redoksreaksjon innebærer en oksidasjons- og reduksjonsreaksjon mellom analytten og titranten. Det er ingen slik regel at komponent oksiderer og hvilken som reduserer. Enten analytten eller titranten oksyderer, og den gjenværende komponenten reduseres tilsvarende. Bestemmelse av sluttpunktet:
Syrebase-titrering:
Generelt brukes en pH-indikator, en pH-måler eller en konduktivitetsmåler for å bestemme sluttpunktet for en syre-base titrering. Redoks Titrering:
De mest brukte metodene for å bestemme sluttpunktet av en redoksreaksjon bruker et potensiometer eller en redoksindikator. Men oftest produserer analytten eller titranten en farge ved sluttpunktet. Så det er ikke nødvendig med flere indikatorer i de tilfellene. Eksempler:
Syre-base-titrering:
- diff Artikkel Midt før tabell ->
Type| Reaksjon (indikator) | Sterk syre - sterk base titrering |
| HCl + NaOHàNaCl + H | 2 O (fenolftalein / metyl oransje) Sterk syre - svak basetitrering |
| HCl + NH | 3 à NH 3 Cl (metylorange) Svak syre - sterk base titrering |
| CH | 3 COOH + NaOHà CH 3 COONa + H 2 O (fenolftalein) Svak syre-svikt base titrering |
| CH | 3 COOH + NH 3 COO - + NH 4 + Redoks-titrering: 2 KMnO |
4
+ 5 H 2 C 2 O 4 + 6 HC1 → 2 MnCl 2 + 2KCl + 10 CO 2 + 8 H 2 O (+7) (+3) (+2) 4) I ovennevnte reaksjon reduseres permanganat mens oxalsyre oksyderes. Når reaksjonen fullføres, endres den lilla fargen av permanganat til fargeløs. KMnO
4
+9FeCl
2 + 8HCl → 5FeCl 3 + MnCl 2 + KCl + 4H 2 O (+ 7) (+2) (+3) (+2) Bilde Courtesy: 1. Titrering av svak syre med sterk base ved Quantumkinetics (eget arbeid) [CC BY 3. 0], via Wikimedia Commons
2. "Winkler Titration Prior Titration" av Willwood [CC BY-SA 3. 0] via Commons




