Forskjell mellom acetaldehyd og aceton | Acetaldehyd vs aceton
Nøkkelforskjell - Acetaldehyd vs Acetone
Både Acetaldehyd og aceton er små organiske molekyler, men det er en forskjell mellom dem basert på deres funksjonelle grupper. Med andre ord er de to forskjellige karbonylforbindelser med forskjellige kjemiske og fysiske egenskaper. Aceton er det minste medlem av ketongruppen, mens acetaldehyd er det minste medlemmet av aldehydgruppe. nøkkelforskjellen mellom acetaldehyd og aceton er antall karbonatomer i strukturen; aceton har tre karbonatomer , men acetaldehyd har bare to karbonatomer. Forskjellen i antall karbonatomer og har to forskjellige funksjonelle grupper fører til mange andre forskjeller i egenskapene deres.
Hva er aceton?
Aceton er det minste medlem av ketongruppen, også kjent som propanon . Det er en fargeløs, flyktig, brannfarlig væske som brukes som løsningsmiddel. De fleste organiske løsningsmidler oppløses ikke i vann, men aceton er blandbar med vann. Det brukes ofte til rengjøringsmessige formål i laboratoriet og som hovedaktiv ingrediens i neglelakkfjernervæsker og i maling tynnere.

Hva er acetaldehyd?
Acetaldehyd, også kjent som etanal , er det minste medlemmet av aldehydgruppe. Det er en fargeløs, brannfarlig væske med sterk kvelende lukt. Det er mange industrielle anvendelser som å produsere eddiksyre, parfymer, stoffer og noen smaker.
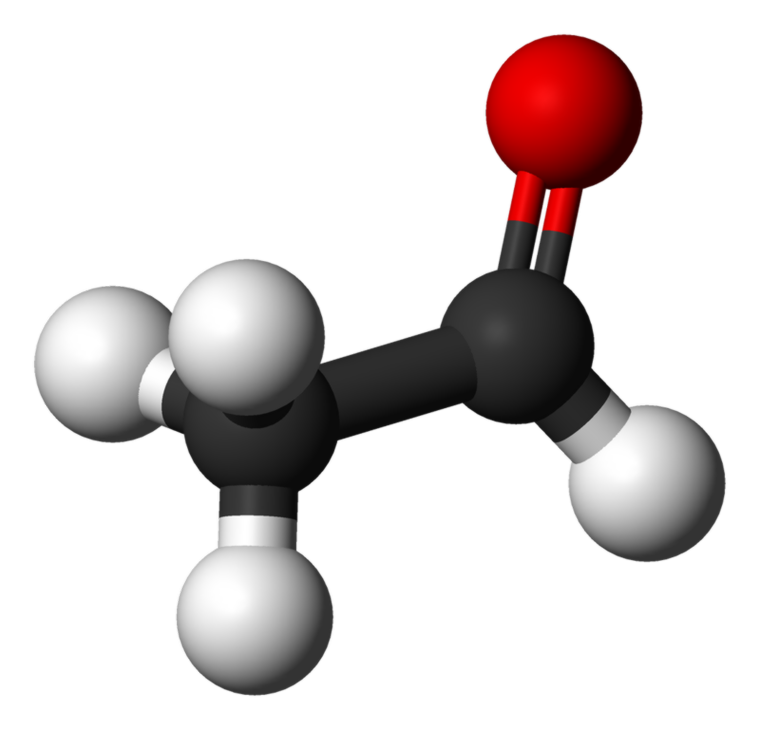
Hva er forskjellen mellom acetaldehyd og aceton?
Struktur og generelle egenskaper for acetaldehyd og aceton
Aceton: Molekylformelen av aceton C 3 H 6 O. Det er det enkleste medlemmet av ketonfamilien. Det er en flyktig, brannfarlig væske med en skarp lukt.

Acetaldehyd: Molekylformelen av acetaldehyd C 2 H 4 O. Det er den enkleste og en av de viktigste medlemmene av aldehydfamilien. Det er en fargeløs, flyktig, brannfarlig væske ved romtemperaturen.

Forekomst av acetaldehyd og aceton
Aceton: Generelt er aceton tilstede i humant blod og urin. Det genereres også og avhendes i menneskekroppen under normal metabolisme. Når folk har diabetikere, blir det produsert i større mengder i menneskekroppen.
Acetaldehyd: Acetaldehyd finnes naturlig i forskjellige planter (kaffe), brød, grønnsaker og modne frukter.I tillegg er det funnet i sigarettrøyk, bensin og diesel eksos. Det er også et mellomprodukt i alkoholens metabolisme.
Anvendelse av acetaldehyd og aceton
Aceton: Aceton brukes hovedsakelig som et organisk løsningsmiddel i kjemiske laboratorier, og er også det aktive middel i å produsere neglelakkfjerner og tynnere i malingsindustrien.
Acetaldehyd: Aceton brukes til å produsere eddiksyre, parfymer, fargestoffer, smaksstoffer og stoffer.
Egenskaper for acetaldehyd og aceton
Identifikasjon
Aceton: Aceton gir et positivt resultat for iodoformtest. Derfor kan det lett differensieres fra acetaldehyd ved bruk av iodoform test.
Acetaldehyd: Acetaldehyd gir et sølvspeilet til "Tollen's reagens", mens ketoner ikke gir et positivt resultat for denne testen. Fordi det ikke kan oksidere lett. Kromsyre-test og Fehlings reagens kan også brukes til å identifisere acetaldehyd.
Reaktivitet
Karbonylgruppernes reaktivitet (aldehyder og ketoner) skyldes hovedsakelig karbonyl-gruppen (C = O).
Aceton: Generelt er alkylgrupper elektrondonerende grupper. Aceton har to metylgrupper og reduserer polariseringen av karbonylgruppen. Derfor gjør det forbindelsen mindre reaktiv. To metylgrupper festet til begge sider av karbonylgruppen fører til mer stearisk hindring også. Derfor er aceton mindre reaktivt enn acetaldehyd.
Acetaldehyd: I kontrast har acetaldehyd bare en metylgruppe og ett hydrogenatom festet til karbonylgruppen. Som metylgruppe donerer elektroner, trekker hydrogenatom elektroner; Dette gjør molekylet mer polarisert, og det gjør molekylet mer reaktivt. Sammenlignet med aceton, har acetaldehyd mindre steariske effekter, og andre molekyler kan nærme seg lett. På grunn av disse grunnene er acetaldehyd mer reaktivt enn aceton.