Forskjell mellom 1s og 2s Orbital | 1s vs 2s Orbital
Nøkkelforskjell - 1s vs 2s Orbital
Atom er den minste enheten av materie. Med andre ord, alt materie er laget av atomer. Et atom består av subatomiske partikler, hovedsakelig protoner, elektroner og nøytroner. Protoner og elektroner gjør kjernen, som ligger i sentrum av atom. Men elektroner er plassert i orbitaler (eller energinivåer) som befinner seg utenfor atomkernen. Det er også viktig å merke seg at orbitaler er hypotetiske begreper som brukes til å forklare den mest sannsynlige plasseringen av et atom. Det er forskjellige orbitaler som omgir kjernen. Det er også suborbitaler som s, p, d, f, etc. S-sub-orbitalen er sfærisk i form når den anses som en 3D-struktur. S-orbitalen har størst sannsynlighet for å finne en elektron rundt kjernen. En sub-orbitall nummereres igjen som 1s, 2s, 3s, etc. i henhold til energinivåene. Hovedforskjellen mellom 1s og 2s omløp er energien til hver orbitale. 1s orbital har en lavere energi enn 2s-banen.
INNHOLD
en. Oversikt og nøkkelforskjell
2. Hva er 1s Orbital
3. Hva er 2s Orbital
4. Side ved side sammenligning - 1s vs 2s Orbital
5. Sammendrag
Hva er 1s Orbital?
1s orbital er orbitalet som er nærmest kjernen. Den har den laveste energien blant andre orbitaler. Det er også den minste sfæriske formen. Derfor er radiusen til s orbital liten. Det kan bare være 2 elektroner i s orbital. Elektronkonfigurasjonen kan skrives som 1s 1 , hvis det bare er én elektron i s-orbitalen. Men hvis det er et par elektroner, kan det skrives som 1s 2 . Da beveger de to elektronene i s orbital mot motsatt retning på grunn av avstengningen som oppstår på grunn av de samme elektriske ladningene til de to elektronene. Når det er en uparget elektron, kalles den paramagnetisk. Det er fordi det kan bli tiltrukket av en magnet. Men hvis orbitalet er fylt og et par elektroner er til stede, kan elektronene ikke bli tiltrukket av en magnet; dette er kjent som diamagnetisk.
Hva er 2s Orbital?
2-orbitalet er større enn 1s omløp. Derfor er radiusen sin større enn den for 1s-banen. Det er det neste skapet omløpende til kjernen etter 1s omløp. Energien er høyere enn 1s omløp, men er lavere enn andre orbitaler i et atom. 2s omløp kan også fylles bare med en eller to elektroner. Men 2s omløp er fylt med elektroner først etter ferdigstillelse av 1s omløp.Dette kalles Aufbau-prinsippet, som angir rekkefølgen av elektronfylling i sub-orbitaler.
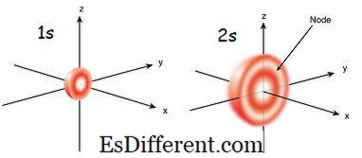
Figur 01: 1s og 2s Orbital
Hva er forskjellen mellom 1s og 2s Orbital?
- diff Artikkel Midt før tabell ->
1s vs 2s Orbital |
|
| 1s orbital er nærmeste orbitale til kjernen. | 2s orbital er det nest nærmeste orbitalet til kjernen. |
| Energi Nivå | |
| Energi av 1s orbital er høyere enn for 2s omløp. | 2s har forholdsvis lavere energi. |
| Radius av orbital | |
| Radien på 1s-omløp er mindre. | Radien på 2s omløp er relativt stor. |
| Orbitalstørrelse | |
| 1s bane har den minste sfæriske formen. | 2s orbital er større enn 1s omløp. |
| Elektronfylling | |
| Elektroner fylles først i 1s-omgangen. | 2s omløp fylles først etter ferdigstillelse av elektroner i 1s-bane. |
Sammendrag - 1s vs 2s Orbital
Et atom er en 3D-struktur som inneholder en kjernekjerne omgitt av ulike formet orbitaler av forskjellige energinivåer. Disse orbitaler er igjen delt inn i sub-orbitaler i henhold til små energiforskjeller. Elektroner, som er en stor subatomisk partikkel av et atom, ligger i disse energinivåene. 1s og 2s sub-orbitaler er nærmest kjernen. Hovedforskjellen mellom 1s og 2s orbitals er forskjellen på deres energinivå, som er 2s orbital er et høyere energinivå enn 1s orbitalt.
Referanse:
1. Libretexts. "Atomiske Orbitaler. "Kjemi LibreTexts. Libretexts, 03 Nov. 2015. Web. 26. mai 2017..
2. Atomer, elektroner og orbitaler. N. p., n. d. Web. 26. mai 2017..
Image Courtesy:
1. "S orbitals" (beskåret) Av CK-12 Foundation - Fil: High School Chemistry. pdf, side 265 (CC BY-SA 3. 0) via Commons Wikimedia




